
【题目】根据下图回答:
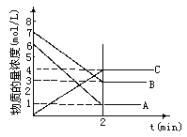
(1)反应物是__________;.
(2)2min内A的平均速率是________;
(3)写出化学方程式_________________。
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】300 mL恒容密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:下列说法不正确的是( )
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:下列说法不正确的是( )
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
A. 上述反应为放热反应
B. 在25 ℃时,反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为2×10-5
Ni(s)+4CO(g)的平衡常数为2×10-5
C. 在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v正<v逆
D. 在80 ℃达到平衡时,再次充入一定量的Ni(CO)4气体再次平衡后, CO的体积分数增大,平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是
甲 | 乙 | 丙 | |
装置 |
|
|
|
现象 | 金属W不断溶解 | Y 的质量增加 | W上有气体产生 |
A.装置甲中W作原电池负极
B.装置乙中Y电极上的反应式为Cu2++2e=Cu
C.装置丙中溶液的c(H+)不变
D.四种金属的活动性强弱顺序为Z>W>X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生的绿色能源,![]() 是一种温室气体,都是重要的化工原料。
是一种温室气体,都是重要的化工原料。
(1)已知CO的燃烧热![]() 为
为![]() ,CO(g)+2H2(g)
,CO(g)+2H2(g)![]() CH3OH(1);△H=-129kJmol-1,欲求出
CH3OH(1);△H=-129kJmol-1,欲求出![]() 的燃烧热,则需要知道一个反应,该反应的热化学方程式为____________________.(无需写出
的燃烧热,则需要知道一个反应,该反应的热化学方程式为____________________.(无需写出![]() 的具体数值)
的具体数值)
(2)向温度不同容积均为1L的a、b、c、d、e五个恒容密闭容器中各充入![]() 、
、![]() 的混合气体,控制适当条件使其同时发生反应:CO2(g)+3H2(g)
的混合气体,控制适当条件使其同时发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=QkJmol-1,反应过程中维持各容器温度不变,测得
CH3OH(g)+H2O(g)△H=QkJmol-1,反应过程中维持各容器温度不变,测得![]() 时刻各容器中
时刻各容器中![]() 的体积分数(H2O)如图所示。
的体积分数(H2O)如图所示。

①Q_______(填“>”或“<”)0,五个容器中肯定处于非平衡状态的是_________。
②![]() 时刻时,容器a中正反应速率________(填“大于”“小于”或“等于”)容器e中正反应速率;
时刻时,容器a中正反应速率________(填“大于”“小于”或“等于”)容器e中正反应速率;
③![]() ℃时,该反应的平衡常数K=__________;
℃时,该反应的平衡常数K=__________;
④欲提高![]() 的转化率,可采取的措施有______________________(写出两种);
的转化率,可采取的措施有______________________(写出两种);
(3)碳捕捉技术的应用既可降低碳排放也可得到重要的化工产品.
①![]() 溶液是常用的碳捕捉剂,若某次捕捉后得到的溶液中c(HCO3-)∶c(CO32-)=2∶1,则所得溶液的pH=__________[常温下
溶液是常用的碳捕捉剂,若某次捕捉后得到的溶液中c(HCO3-)∶c(CO32-)=2∶1,则所得溶液的pH=__________[常温下![]() 、
、![]() ]。
]。
②在清除锅炉水垢的过程中,需要用![]() 将水垢中的
将水垢中的![]() 转化为
转化为![]() ,将微溶的
,将微溶的![]() 难溶性的
难溶性的![]() 的理由是_____________________________________________.
的理由是_____________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应C(s)+H2O(g) ![]() CO(g)+H2(g) △H>0 达到平衡,下列叙述正确的是
CO(g)+H2(g) △H>0 达到平衡,下列叙述正确的是
A. 升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B. 加入固体炭,平衡向正反应方向移动
C. 加入水蒸气,平衡向逆反应方向移动
D. 扩大容器的容积,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中不属于氧化还原反应的是( )
A.H2+CuO![]() Cu+H2OB.2Na+Cl2
Cu+H2OB.2Na+Cl2![]() 2NaCl
2NaCl
C.2H2O2![]() 2H2O+O2 ↑D.Na2SO4+BaCl2 = 2NaCl + BaSO4↓
2H2O+O2 ↑D.Na2SO4+BaCl2 = 2NaCl + BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为短周期的一部分,Y原子最外层电子数是其电子层数的 2倍,下列说法正确的是

A.Y的氢化物比 Z的氢化物稳定
B.原子半径大小为Z>Y>R>X
C.Y、R形成的化合物 YR2能使酸性 KMnO4溶液褪色
D.四种元素中最高价氧化物的水化物酸性最强的是 Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如右图所示。据图分析,下列判断错误的是

A. Ksp[Fe(OH)3]< Ksp [Cu(OH)2]
B. Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
C. 加适量NH4Cl固体可使溶液由a点变到b点
D. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是用石墨和铁作电极电解饱和食盐水的装置,请填空:

(1)X的电极反应式为:___________________________________,Y极的电极材料是_______________。
(2)某同学在实验时误将两种电极材料接反,导致X极上未收集到预期产物,一段时间后又将两极的连接方式纠正过来,发现X极附近出现了白色沉淀,此沉淀是________(填化学式),其形成原因是:___________________________________。

(3)工业上电解饱和食盐水的方法之一是将两个电极室用离子交换膜隔开(如图所示),其目的是_____________,阳极室(A处)加入________,离子交换膜只许________通过。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com