
0.5mol·L-1的一元酸A和未知浓度的一元强碱B以1∶2的体积比混合,所得溶液中[OH-]=0.1mol·L-1,用B中和20mL[H+]为0.01mol·L-1的一元弱酸C,当恰好完全反应时,用去5mL B溶液,求弱酸C的电离度.(电离度是指弱电解质达到电离平衡时,已电离的电解质分子数占原电解质分子数的百分数)
科目:高中化学 来源: 题型:
《环境空气质量标准》中,有害气体的浓度常用标准状况下,每立方米气体中含有害气体的毫克值(mg/m3)来表示,对CO的浓度限值规定为:
一、二级标准:4.00,三级标准:6.00 。一环保检测中心对采集的0.02m3(标况)某区域空气样品中所含CO的浓度进行测定,其方法和实验步骤如下:
① 首先将空气样品通过盛有I2O5固体的加热管,反应生成CO2和I2(不考虑其他气体的反应);
② 用30.0mL 5.00×10-5mol·L-1过量的硫代硫酸钠溶液完全吸收反应所产生的碘,发生的反应为:I2+2S2O32-=2I-+S4O62-
③ 将②反应后溶液取出1/2,放入锥形瓶中,加入几滴指示剂,用1.00×10-5mol·L-1的标准碘溶液进行滴定,滴定至终点,实验记录如下:
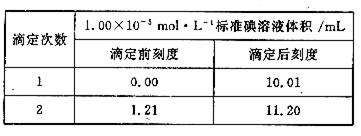
(1) 写出中反应的化学方程式:
(2) 计算该空气样品中CO的浓度,并说明符合几级标准。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省双流市外语学校高三9月月考化学试卷(解析版) 题型:选择题
酸性高锰酸钾溶液能将醇氧化成一系列产物,反应中KMnO4被还原为Mn2+。用0.5mol·L-1的酸性高锰酸钾溶液滴定20.0mL0.25mol·L-1的乙二醇溶液,当用去20.0mL高锰酸钾溶液时,再加一滴高锰酸钾溶液恰好呈紫色,振荡后不褪色。则乙二醇被氧化为
A.HOCH2-CHO B.OHC-CHO C.HOOC-CHO D.CO2
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
硫酸铜是一种应用极其广泛的化工原料。铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)。
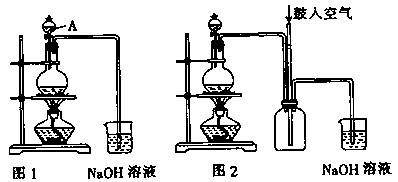
(1)图1烧瓶中发生的反应的离子反应方程式为: 。
(2)图2是图1的改进装置,其优点有:
① ;
② 。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加FeSO4或Fe2(SO4)3,即发生反应。反应完全后向其中加物质甲调节pH到3―4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,滤渣作催化剂循环使用。(已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4。)
请回答下列问题:
①方案1中的B仪器名称是 。
②方案2中甲物质是 (填字母序号)。
a、CaO b、CuCO3 c、CaCO3
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol?L-1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h后,升温到60℃,持续反应1 h后,过滤、蒸发结晶、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4?5H2O 10.6g。
请回答下列问题:
③加热时温度不宜过高的原因是 ,晶体采用酒精淋洗的优点是 。
④上述两种氧化法中,更符合绿色化学理念的是 (填“第一组”或“第二组”),理由是 、
、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学为测定某烧碱样品中含NaOH的纯度(设样品中杂质为NaCl),进行如下实验:
(1)称取样品:调节托盘天平到零点后,在天平两盘放质量大小相同纸片,使天平保持平衡,向左盘放一个5g砝码,将游码拨0.2g处;向右盘纸片上缓缓小心加烧碱颗粒到天平达平衡。该操作的错误之处有: 。按如上操作,该同学称取烧碱样品的实际量应是 。
(2)配制溶液:将纸片上的烧碱样品小心移入100mL容量瓶中,加蒸馏水到刻度,盖紧瓶塞,反复倒置摇匀,该操作的错误是 。按此方法所配制得的溶液浓度应 (从“偏高”或“偏低”等词中选填)
(3)取液:将用蒸馏水洗净的锥形瓶再用所配制碱液润洗2~3次,再用蒸馏水洗净的移液管取10mL所配碱液移入锥形瓶,再向瓶中加入约15mL蒸馏水将碱液稀释。此操作中错误之处是 。
(4)滴定:向锥形瓶中加入约2mL酚酞溶液,用浓度为0.5mol?L-1的盐酸标准液进行滴定,滴定时左手操作滴定管,右手猛力振荡锥形瓶,当锥形瓶中溶液颜色刚变粉红色时,停止滴定,记下耗酸体积数,此步操作中错误之处是 。
将(3)(4)操作重复一次
(5)计算:取两次操作耗标准酸液体积平均值为20.00mL,依此数据计算出烧碱样品中含NaOH的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2013届四川省双流市棠中外语学校高三9月月考化学试卷(带解析) 题型:单选题
酸性高锰酸钾溶液能将醇氧化成一系列产物,反应中KMnO4被还原为Mn2+。用0.5mol·L-1的酸性高锰酸钾溶液滴定20.0mL0.25mol·L-1的乙二醇溶液,当用去20.0mL高锰酸钾溶液时,再加一滴高锰酸钾溶液恰好呈紫色,振荡后不褪色。则乙二醇被氧化为
| A.HOCH2-CHO | B.OHC-CHO | C.HOOC-CHO | D.CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com