
| A. | 在碱性溶液中,Na+、S2-、K+、AlO2- | |
| B. | 在酸性溶液中,SO32-、S2-、K+、NH4+ | |
| C. | 在酸性溶液中,Fe2+、Cu2+、Cl-、NO3- | |
| D. | 在酸性溶液中,Fe2+、Cl-、Na+、SO42- |
分析 A.四种离子之间不发生反应,都不与碱性溶液中的氢氧根离子反应;
B.酸性溶液中存在大量氢离子,亚硫酸根离子、硫离子在酸性条件下反应生成硫单质;
C.硝酸根离子在酸性条件下具有强氧化性,能够氧化亚铁离子;
D.四种离子之间不反应,都不与酸性溶液中的氢离子反应.
解答 解:A.Na+、S2-、K+、AlO2-之间不反应,都不与碱性溶液中的氢氧根离子反应,在溶液中能够大量共存,故A正确;
B.酸性溶液中存在大量氢离子,SO32-、S2-在酸性溶液中发生氧化还原反应生成S单质,在溶液中不能大量共存,故B错误;
C.Fe2+、NO3-在酸性条件下能够发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.酸性溶液中存在大量氢离子,Fe2+、Cl-、Na+、SO42-之间不反应,且都不与氢离子反应,在溶液中能够大量共存,故D正确;
故选AD.
点评 本题考查了离子共存的判断,题目难度中等,注意掌握离子反应发生条件,明确题干暗含条件的含义,特别注意酸性条件下硝酸根离子具有强氧化性,能够氧化具有还原性的离子,如亚铁离子、碘离子等,为易错点.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
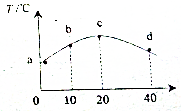 若往20mL 0.01mol•L-1的HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
若往20mL 0.01mol•L-1的HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )| A. | HNO2的电离平衡常数:c点>b点 | |
| B. | 若b点混合溶液显酸性,则2c(Na+)=c(NO2-)+c(HNO2) | |
| C. | c点混合溶液中:c(Na+)>c(OH-)>c(NO2)>c(H+) | |
| D. | d点混合溶液中:c(OH-)=c(HNO2)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 C、N、O、Al、Si、Cu是常见的六种元素.
C、N、O、Al、Si、Cu是常见的六种元素.| 原子半径 | 电负性 | 熔点 | 沸点 |
| Al>Si | N<O | 金刚石>晶体硅 | CH4<SiH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
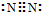 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com