
【题目】(1)在 20mL 0.0020mol·L-1NaCl 溶液中加入 20 mL 0.020mol·L-1 AgNO3 溶液,________(有、无)AgCl 沉淀生成 ,此时溶液中 Cl-离子浓度为 _____mol·L-1。已知 AgCl 的 Ksp=1.8×10-10
(2)下列物质中属于强电解质且能导电的是________
①固体食盐 ②熔融 KNO3 ③CuSO4·5H2O ④液溴 ⑤蔗糖 ⑥CO2 气体 ⑦盐酸 ⑧液态醋
(3)1gH2 完全燃烧生成液态水时放出 142.5kJ 的热量,写出表示 H2 燃烧热的热化学方程式________。
【答案】有 2×10-8 ② H2(g)+ ![]() O2(g)=H2O(l) H=-285 kJ/mol。
O2(g)=H2O(l) H=-285 kJ/mol。
【解析】
(1)等体积混合浓度减半,c(Cl-)=0.0010mol/L,c(Ag+)=0.010mol/L,AgNO3过量,Qc=0.0010 mol/L×0.010 mol/L=1×10-5> Ksp=1.8×10-10,有AgCl沉淀生成;溶液中剩余的银离子的量为:n(Ag+)=n(Ag+)-n(Cl-)=0.02L×0.020mol·L-1-0.02L ×0.0020mol·L-1=3.6×10-4mol,c(Ag+)=![]() =9×10-3mol/L,根据AgCl的 Ksp=1.8×10-10可知,此时溶液中c(Cl-)=
=9×10-3mol/L,根据AgCl的 Ksp=1.8×10-10可知,此时溶液中c(Cl-)= ![]() =2×10-8mol/L;
=2×10-8mol/L;
故答案为:有;2×10-8;
(2)①固体食盐不是纯净物,不属于电解质,也不能导电;②熔融KNO3 能导电,且是强电解质;③CuSO4·5H2O是电解质,但不能导电;④液溴为单质,不是电解质,也不能导电;⑤蔗糖属于非电解质,不能导电;⑥CO2气体属于非电解质,不能导电;⑦盐酸为混合物,不属于电解质,但能导电;⑧液态醋是弱电解质,不能导电;故选②;
故答案为:②;
(3)燃烧热是指1mol纯物质与氧气反应完全燃烧生成稳定的氧化物所放出的能量,1gH2为0.5mol,完全燃烧生成液态水时放出142.5KJ 的热量,燃烧热的热化学反应方程式为:H2(g)+ ![]() O2(g)=H2O(l) H=-285kJ/mol;
O2(g)=H2O(l) H=-285kJ/mol;
故答案为:H2(g)+ ![]() O2(g)=H2O(l) H=-285 kJ/mol。
O2(g)=H2O(l) H=-285 kJ/mol。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)的传感器在煤矿巷道中的甲烷达到一定浓度时可以显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,

其中的固体电解质是Y2O3—Na2O,O2-可以在其中自由移动。下列有关叙述不正确的是
A.电极b是正极,内电路中O2-由电极b流向电极a
B.电极a的反应式为:CH4 +4O2--8e-=CO2 +2H2O
C.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
D.当固体电解质中有1 mol O2- 通过时,电子转移2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C均为含铁化合物,请根据以下四种物质的转化过程回答相关问题:
![]()
(1)反应①、②、③中属于氧化还原反应的是_______(填序号);
(2)向B的溶液中滴入几滴KSCN溶液后.可观察到的现象是______________________
(3)C的化学式为____________:
(4)写出反应②的离子方程式__________;
(5)选择合适的试剂也可以实现B转化为A,请写出利用你选的试剂实现该转化的化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】贝诺酯是一种解热镇痛药,在酶的作用下可以释放出阿司匹林和扑热息痛,其结构为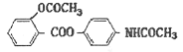 ,其合成途径如下:
,其合成途径如下:
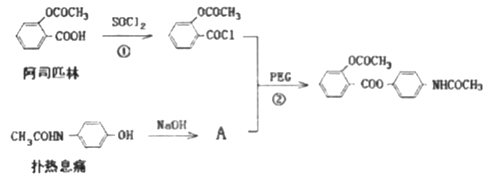
完成下列填空:
(1)反应①的反应类型为________________,有机物A与扑热息痛的式量相差______________
(2)贝诺酯所含的含氧官能团是__________
(3)写出反应②的化学方程式_____________
(4)关于阿司匹林性质叙述正确的是(填选项编号)____________
A.能与氯化铁溶液发生显色反应 B.能与氢氧化铜悬浊液反应
C.能发生消去反应 D.能发生酯化反应
(5)符合下列条件的扑热息痛的同系物共有_________种,写出其中一种的结构简式___________。
①碳原子数比扑热息痛多2个 ②苯环上只有2个对位的支链 ③含有2个甲基
(6)若已知:
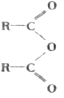 +R'OH
+R'OH![]() RCOOH +RCOOR'
RCOOH +RCOOR'
现以苯酚和乙酸酐(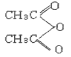 )为有机原料,合成阿司匹林,请设计完成下列合成途径______(合成路线常用的表示方法为:A
)为有机原料,合成阿司匹林,请设计完成下列合成途径______(合成路线常用的表示方法为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的 CaCO3 与 l00mL 稀盐酸反应制取 CO2,实验过程记录如图所示(CO2 的体积己折算为标准状况下的体积)。下列分析正确的是( )
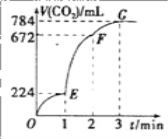
A.EF 段,用盐酸表示该反应的平均反应速率为 0.4 mol·(L·min) -1
B.OE 段表示的平均速率最快
C.F 点收集到的 CO2 的量最多
D.OE、EF、FG 三段中,该反应用二氧化碳表示的平均反应速率之比为 2∶6∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
M2+(g)+CO32-(g) ![]() M2+(g)+O2(g)+CO2(g)
M2+(g)+O2(g)+CO2(g)
![]()
![]()
![]()
已知:离子电荷相同时,半径越小,离子键越强。下列说法不正确的是
A. ΔH1(MgCO3)>ΔH1(CaCO3)>0
B. ΔH2(MgCO3)=ΔH2(CaCO3)>0
C. ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO)
D. 对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
A. 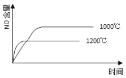
B. 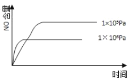
C. 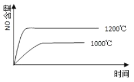
D. 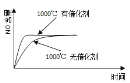
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有K2Cr2O7的废水具有较强的毒性,工业上常用钡盐沉淀法处理含有 K2Cr2O7 的废水并回收重铬酸,具体的流程如下:
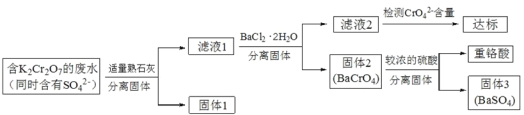
已知:CaCr2O7、BaCr2 O7 易溶于水,其它几种盐在常温下的溶度积如下表所示。
物质 | CaSO4 | CaCrO4 | BaCrO4 | BaSO4 |
溶度积 | 9.1106 | 2.30 102 | 1.17 1010 | 1.08 1010 |
(1)用离子方程式表示K2Cr2O7溶液中同时存在 K2CrO4的原因(将离子方程式补充完整):______Cr2O72-+______![]() ____CrO42+______
____CrO42+______
(2)向滤液 1 中加入 BaCl2 ![]() 2H2O 的目的是使 CrO42- 从溶液中沉淀出来。
2H2O 的目的是使 CrO42- 从溶液中沉淀出来。
①结合上述流程说明熟石灰的作用:_____。
②结合表中数据,说明选用Ba2 不选用Ca2处理废水的理由:_____。
③ 研究温度对CrO42 沉淀效率的影响。实验结果如下:在相同的时间间隔内,不同温度下CrO42- 的沉淀率(沉淀率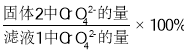 如图所示)
如图所示)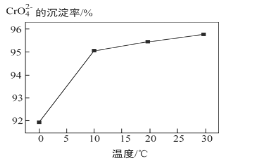
已知:![]()
CrO42- 的沉淀效率随温度变化的原因是_____。
(3)向固体2中加入硫酸,回收重铬酸。
①硫酸浓度对重铬酸的回收率如下图(左)所示。结合化学平衡移动原理,解释使用 0.450 mol/L 的硫酸时,重铬酸的回收率明显高于使用 0.225 mol/L 的硫酸的原因:_____。
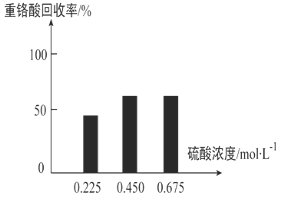
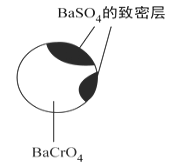
②回收重铬酸的原理如上图(右)所示。当硫酸浓度高于0.450 mol/L时,重铬酸的回收率没有明显变化,其原因是_____。
(4)综上所述,沉淀BaCrO4进一步回收重铬酸的效果与_____、_____、有关。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com