
分析 由KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O可知,KClO3中Cl元素的化合价由+5价降低为0,HCl中Cl元素的化合价由-1价升高为0,根据电子转移和氯气之间的关系进行计算解答.
解答 解:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O的反应中,KClO3中Cl元素的化合价由+5价降低为0,氧化剂是KClO3,被还原,还原产物为Cl2,还原剂是HCl,双线桥法表示氧化还原反应为 ,如果有3mol Cl2(标准状况)生成,则转移电子5mol,如果有6.72L级0.3mol Cl2(标准状况)生成,则转移电子0.5mol,个数是3.01×1023,故答案为:
,如果有3mol Cl2(标准状况)生成,则转移电子5mol,如果有6.72L级0.3mol Cl2(标准状况)生成,则转移电子0.5mol,个数是3.01×1023,故答案为: ;HCl;3.01×1023.
;HCl;3.01×1023.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:选择题
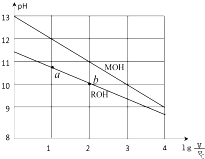 室温下,将浓度均为0.10mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随$lg\frac{V}{V_0}$的变化如图所示,下列叙述错误的是( )
室温下,将浓度均为0.10mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随$lg\frac{V}{V_0}$的变化如图所示,下列叙述错误的是( )| A. | ③⑤ | B. | ①⑤ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 分液、蒸馏、萃取 | C. | 萃取、蒸馏、分液 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C60能溶于二硫化碳中形成无色透明的溶液,可以用相似相溶原理解释 | |
| B. | 向含有Fe2+的溶液中滴加无色的铁氰化钾溶液,可以观察到蓝色沉淀产生 | |
| C. | 甲烷是空间正四面体结构,四个氢的相对位置完全等效,其任意取代物都不会产生同分异构现象 | |
| D. | 电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
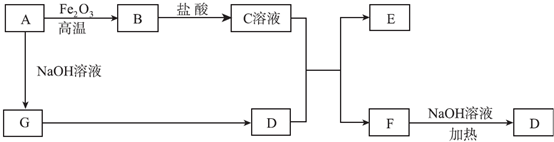
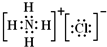 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com