
| A. | 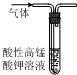 除去CO2中混有的SO2 | B. | 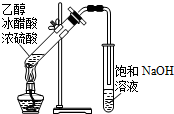 制取较纯净的乙酸乙酯 | ||
| C. | 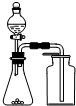 用生石灰和浓氨水制取氨气 | D. | 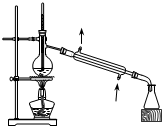 分离苯和四氯化碳的混合物 |
分析 A.二氧化硫能被酸性高锰酸钾溶液氧化生成硫酸根离子,二氧化碳和酸性高锰酸钾溶液不反应;
B.制取纯净的乙酸乙酯用饱和碳酸钠溶液;
C.氨气密度小于空气,应该采用向下排空气法收集;
D.蒸馏时温度计测量馏分温度.
解答 解:A.二氧化硫能被酸性高锰酸钾溶液氧化生成硫酸根离子,二氧化碳和酸性高锰酸钾溶液不反应,所以可以用酸性高锰酸钾溶液除去CO2中混有的SO2,故A正确;
B.制取纯净的乙酸乙酯用饱和碳酸钠溶液,NaOH能促进乙酸乙酯水解,故B错误;
C.氨气密度小于空气,且常温下和空气不反应,所以应该采用向下排空气法收集,故C错误;
D.蒸馏时温度计测量馏分温度,所以温度计水银球应该位于蒸馏烧瓶支管口处,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,侧重考查实验基本操作,明确实验原理是解本题关键,注意从操作规范性及评价性进行分析,易错选项是B,知道饱和碳酸钠溶液的作用.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:解答题
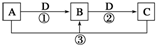 已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫不能使溴水、高锰酸钾溶液迅速褪色 | |
| B. | 接触法制硫酸的沸腾炉排出的炉气中含SO2 | |
| C. | 实验室可用启普发生器制取二氧化硫 | |
| D. | 用石灰水很容易区分二氧化碳和二氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为:2H+-2e-═H2↑ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 钢铁发生电化学腐蚀的负极反应式:Fe-2e-═Fe2+ | |
| D. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X有多种气态氢化物 | B. | 原子半径:R>W | ||
| C. | 气态氢化物的热稳定性:R>Y | D. | 最高价氧化物的水化物的酸性:X>R |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com