
钛(Ti)因为具有神奇的性能越来越引起人们的关注。常温下钛不和非金属、强酸反应。红热时,却可与常见的非金属单质反应。钛是航空、军工、电力等方面的必需原料。地壳中含钛矿石之一是金红石(TiO2),目前大规模生产钛的方法是:第一步:金红石、碳粉混合,在高温条件下通入Cl2制得TiCl4和一种可燃性气体,该反应的化学方程式为______________________________,该反应的还原剂是________。
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。
(1)写出此反应的化学方程式:_____________________________________________。
(2)简述从上述所得产物中获取金属钛的步骤___________________________ _______________________________________________________________________。
解析: 因为钛①常温下不与非金属、强酸反应,②红热时可与常见非金属单质反应,可类比一般不活泼金属氧化物,选用碳做还原剂制取金属,金属与Cl2生成氯化物。两反应合并的化学方程式为:TiO2+2C+2Cl2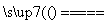 TiCl4+2CO。
TiCl4+2CO。
第二步:(1)Mg为活泼金属,在氩气作为保护气的环境中还原TiCl4:2Mg+TiCl4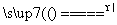 2MgCl2+Ti。(2)还原出的Ti与Mg混合,分离时用强酸,因钛不与强酸反应,而Mg溶于强酸中,然后过滤、洗涤,即可得纯净钛。
2MgCl2+Ti。(2)还原出的Ti与Mg混合,分离时用强酸,因钛不与强酸反应,而Mg溶于强酸中,然后过滤、洗涤,即可得纯净钛。
答案: 第一步:TiO2+2C+2Cl2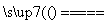 TiCl4+2CO C
TiCl4+2CO C
第二步:(1)2Mg+TiCl4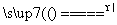 2MgCl2+Ti
2MgCl2+Ti
(2)将还原后的产物溶于过量的盐酸中,然后过滤、洗涤,即可得到纯净的钛


 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述中错误的是( )
A.16.9 g过氧化钡(BaO2)固体中阴、阳离子总数为0.3NA
B.在1 L 0.1 mol/L碳酸钠溶液中,阴离子总数大于0.1 NA
C.标准状况下,2.24 L Cl2分别与足量 Fe或Cu反应转移的电子数均约为0.2NA
D.常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体原子间的共用电子共6NA对
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡:
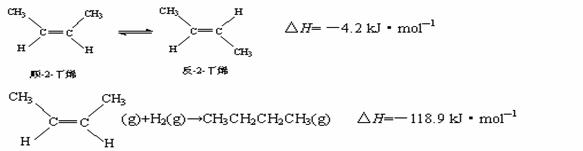
下列说法正确的是( )
A.顺-2-丁烯比反-2-丁烯稳定
B.顺-2-丁烯的燃烧热比反-2-丁烯大
C.加压和降温有利于平衡向生成顺-2-丁烯反应方向移动
D.反-2-丁烯氢化的热化学方程式为:
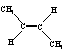 (g)+H2(g)→CH3CH2CH2CH3(g) △H=-123.1 kJ·mol-1
(g)+H2(g)→CH3CH2CH2CH3(g) △H=-123.1 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是( )
A.Al B.Al(OH)3
C.AlCl3 D.Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于金属元素特征的叙述正确的是( )
A.金属元素的原子只有还原性,离子只有氧化性
B.金属元素在化合物中一定显正价
C.金属元素在不同化合物中化合价均不同
D.金属单质在常温下均是固体
查看答案和解析>>
科目:高中化学 来源: 题型:
1)已知Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为10 mL):
| 实验编号 | 实验温度/℃ | c(Na2S2O3) /mol·L-1 | c(H2SO4) /mol·L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
其他条件不变时,探究温度对化学反应速率的影响,应选择__________(填实验编号);探究浓度对化学反应速率的影响,应选择__________(填实验编号);若同时选择①②③溶液变浑浊的同时,探究__________对化学反应速率的影响。
(2)已知Na2S2O3溶液与Cl2反应时,1 mol Na2S2O3转移8 mol电子。该反应的离子方程式是____________________________________________________________,
甲同学设计如下实验流程探究Na2S2O 3的化学性质。
3的化学性质。
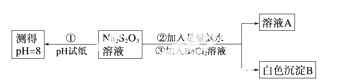
(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和________性。
(Ⅱ)加入BaCl2溶液生成白色沉淀B的离子方程式是________________________。
(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是________(填“甲”或“乙”),理由是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
|
| i. 液面上方出现白雾; ii. 稍后,出现浑浊,溶液变为黄绿色; iii. 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)C12和Ca(OH)2制取漂粉精的化学方程是 。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是 。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HC1小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
① 实验a目的是 。
。
②由实验a、b不能判断白雾中含有HC1,理由是 。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是 。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是 。
②用离子方程式解释现象iii中黄绿色褪去的原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
I.在温度为T时,向2.0 L恒容密闭容器中充入1.0 mol A和1.0 mol B,发生反应A(g)+B(g)  C(g),一段时间后达到平衡。测定得部分数据见下表:
C(g),一段时间后达到平衡。测定得部分数据见下表:
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
回答下列问题:
(1)反应前5 s的平均反应速率v(A) =____________
(2)温度为T时,该反应的化学平衡常数=
(3)升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH (填 “>0” 或 “<0”)
(4)相同温度下,起始时向容器中充入0.2 mol A、0.2 mol B和1.0 mol C,反应达到平衡前,反应速率v正 v逆(填“>” 或 “<”)
(5)下列措施能增大反应速率,且平衡往正反应方向移动是 。
a.及时分离出A气体 b.适当升高温度
c.增大B的浓度 d.选择高效催化剂
II.NO、NO2是常见的氧化物。用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g) △H = -180.5kJ·mol-1
2H2O(l) = 2H2(g) + O2(g) △H = +571.6kJ·mol-1
则用H2催化还原NO消除污染的热化学方程式是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com