
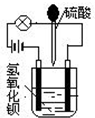
 在烧杯中盛有半杯的Ba(OH)2溶液,然后用滴管向烧杯中滴加H2SO4(装置如右图).随着硫酸的滴入,电灯会逐渐变暗,当两者恰好完全反应时,电灯完全熄灭.
在烧杯中盛有半杯的Ba(OH)2溶液,然后用滴管向烧杯中滴加H2SO4(装置如右图).随着硫酸的滴入,电灯会逐渐变暗,当两者恰好完全反应时,电灯完全熄灭.| n |
| V |
| 0.0075mol |
| 0.025L |
| 1000ρw |
| M |
| 1000×1.84×98% |
| 98 |
| 2.5L×0.3mol/L |
| 18.4mol/L |


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
| A、NaHS水解反应:HS-+H2O?H3O++S2- | ||
| B、明矾加入在水中起净化作用的原因:Al3++3H2O?Al(OH)3(胶体)+3H+ | ||
C、氢氧化钡溶液与稀硫酸反应:Ba2++SO
| ||
| D、碳酸氢钠溶液中加入过量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| B、加入水蒸气使容器压强增大,平衡向逆反应方向移动 |
| C、加入固体碳,平衡向正反应反应方向移动 |
| D、扩大容器的容积,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向明矾溶液中加入过量NaOH溶液会产生大量白色沉淀 |
| B、Na2O2用作呼吸面具的供氧剂 |
| C、氯水中通入SO2后溶液的酸性减弱 |
| D、N2与O2在放电条件下直接化合生成NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验操作 | 实验现象与结论 |
| 取适量溶液B于试管中,滴加 ,放置一段时间后,观察现象. |
若溶液 若溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铁溶液与铁粉反应:Fe3++Fe=2Fe2+ |
| B、NO2与水的反应:3NO2+H2O=2HNO3+NO |
| C、石灰石溶于醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O |
| D、氯化银悬浊液与KI溶液反应:Ag++I=AgI↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com