
【题目】将1 mol甲烷与一定量的氯气混合于一量筒中,倒立于盛有饱和食盐水的水槽(如图所示),对于此反应,有关叙述不正确的是( )
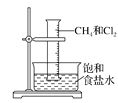
A. 该反应属于取代反应
B. 该反应的条件是光照
C. 该反应的生成物只有四种
D. 该反应现象有量筒内气体颜色变浅,器壁上有油状液滴
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是
A.在溴水中存在如下平衡:Br2+H2O![]() HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B.对于反应:2HI(g)![]() H2(g)+I2(g),使平衡体系缩小体积增加压强,颜色变深
H2(g)+I2(g),使平衡体系缩小体积增加压强,颜色变深
C.Fe(SCN)3溶液中加入固体KSCN后颜色变深
D.棕红色气体NO2(2NO2![]() N2O4)缩小体积加压后,颜色先变深后变浅
N2O4)缩小体积加压后,颜色先变深后变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究乙醇和金属钠反应生成![]() 的原理,某同学做了如下四个实验。
的原理,某同学做了如下四个实验。
甲:向小烧杯中加入无水乙醇,再放入一小块金属钠,观察现象,并收集产生的气体
乙:设法检验甲收集到的气体。
丙:向试管中加人![]() 水,并加入绿豆粒大小的金属钠,观察现象。
水,并加入绿豆粒大小的金属钠,观察现象。
丁:向试管中加人![]() 乙醚(
乙醚(![]() ),并加入绿豆粒大小的金属钠,发现无明显变化。
),并加入绿豆粒大小的金属钠,发现无明显变化。
回答以下问题:
(1)从结构上分析,该实验选取水和乙醚作参照物的原因是__________。
(2)丙的目的是证明_____________;丁的目的是证明_______;根据丙和丁的结果,可以得出乙醇和金属钠反应的化学方程式应为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,ΔH1=-393.5kJ·mol-1,ΔH2=-395.4kJ/mol,下列说法或表示式正确的是

A.金刚石的稳定性强于石墨
B.石墨和金刚石的转化是物理变化
C.C(s、石墨)=C(s、金刚石) ΔH=+1.9kJ·mol-1
D.断裂1 mol石墨中的化学键吸收的能量比断裂1mol金刚石中的化学键吸收的能量少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,下列电解质溶液的有关叙述正确的是
A.在含有 BaSO4 沉淀的溶液中加入 Na2SO4 固体,c(Ba2+)增大
B.同物质的量浓度、同体积的强酸与强碱溶液混合后,溶液的 pH 一定等于 7
C.含 1mol KOH 的溶液与 1mol CO2 完全反应后,溶液中 c(K+)=c(![]() )
)
D.在 CH3COONa 溶液中加入适量 CH3COOH,可使 c(Na+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
①Zn为正极,Cu为负极;
②H+向负极移动;
③电子是由Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤若有1mol电子流过导线,则产生的H2为0.5mol;
⑥正极的电极反应式为Zn﹣2e﹣═Zn2+.

A.①②③ B.③④⑤ C.④⑤⑥ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含![]() 的质量计),某研究小组同学设计了如下实验方案。
的质量计),某研究小组同学设计了如下实验方案。
I.称取样品W g;
II.向样品中加人足量稀硫酸:
III.将II中产生的![]() ,用足量
,用足量![]() 溶液吸收;
溶液吸收;
IV.将III所得硫酸溶夜用氢氧化钠溶液滴定;
V.数据处理。
(1)![]() 是一种食品添加剂。写出
是一种食品添加剂。写出![]() 与稀
与稀![]() 反应的离子方程式:____________
反应的离子方程式:____________
(2)步骤中H2O2的作用是 __________________________
(3)步骤N中可选用的指示剂为__________。下图显示滴定终点时,滴定管(量程为25mL)读数为_______________。
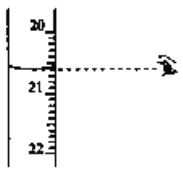
(4)步骤IV中消耗![]() 溶液V mL,则1 kg样品中含
溶液V mL,则1 kg样品中含![]() 的质量是__________g(用含W、V的代数式表示)。
的质量是__________g(用含W、V的代数式表示)。
(5)此实验方案测得亚硫酸盐含量偏低,步骤II会产生该误差,请说明理由。(写出2条)_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2 和 NOx 都是大气污染物。
(1)利用氨水可以将 SO2 和 NO2 吸收,原理如下图所示:

NO2 被吸收的离子方程式是__________________。
(2)湿法吸收工业尾气中的NO2,常选用纯碱溶液,将NO2转化为两种氮元素的常见含氧酸盐,其反应的离子方程式是(已知酸性HNO2>H2CO3)______________。
(3)用高能电子束激活烟气(主要成分是SO2、NO2、H2O等),会产生O3等强氧化性微粒。烟气经下列过程可获得化肥。

该化肥中含有的离子是![]() 、___________(填离子符号)。
、___________(填离子符号)。
(4)SCR 和 NSR 技术可有效降低柴油发动机在空气过量条件下的 NOx 排放。
I.SCR(选择性催化还原)工作原理:

①尿素[CO(NH2)2]水溶液热分解为 NH3 和 CO2,该反应的化学方程式是________________。
②反应器中 NH3 还原 NO2 的化学方程式是_________________。
③当燃油中含硫量较高时,尾气中 SO2 在 O2 作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4 的形成_____________________。
II.NSR(NOx 储存还原)工作原理:NOx 的储存和还原在不同时段交替进行,如下图所示。

①通过 BaO 和 Ba(NO3)2 的相互转化实现 NOx 的储存和还原。储存 NOx 的物质是___________________,生成 Ba(NO3)2 的化学方程式是 _______________。
②用 H2 模拟尾气中还原性气体研究了 Ba(NO3)2 的催化还原过程,该过程分两步进行,下图表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2 与 Ba(NO3)2 的物质的量之比是___________。

③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与 NO 有关。在有氧气条件下 15NO 与 NH3 以一定比例反应时,得到的笑气几乎都是 15N1.5N0.5O。将该反应的化学方程式补充完整:_____________ ![]() _________15N1.5N0.5O+________H2O
_________15N1.5N0.5O+________H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H八种短周期主族元素在周期表中的相对位置如图所示,已知C元素形成的单质有“国防金属”的美誉,![]() 的最高化合价与最低化合价之和为2。回答下列问题:
的最高化合价与最低化合价之和为2。回答下列问题:
A | …… | D | E | F | ||
B | C | …… | G | H |
(1)D元素在周期表中的位置为________________。
(2)上述元素所形成的气态单质中能用于饮用水消毒的有________________(填化学式)。
(3)B的单质在F的单质中燃烧的火焰颜色为________。
(4)C元素的单质可以在D和F形成的一种气态化合物中燃烧,写出该反应的化学方程式_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com