
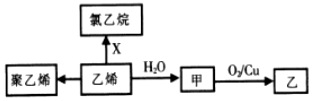
| A. | 1mol聚乙烯含有的原子数目为6NA | B. | CH3OCH3与甲互为同分异构体 | ||
| C. | X为C12 | D. | 甲→乙反应类型为取代反应 |
分析 乙烯含有碳碳双键,发生加聚反应生成聚乙烯,与HCl发生加成反应生成氯乙烷,与水发生加成反应生成甲为乙醇,乙醇在铜催化作用下发生氧化反应生成乙为乙醛,以此解答该题.
解答 解:A.聚乙烯为乙烯的聚合物,为高分子化合物,因聚合物介于较大范围之间,没有确定的值,则不能确定1mol聚乙烯含有的原子数目,故A错误;
B.由以上分析可知甲为乙醇,与CH3OCH3互为同分异构体,故B正确;
C.X应为HCl,如为氯气,则生成1,2-二氯乙烷,故C错误;
D.甲→乙反应类型为氧化反应,乙醇被氧化生成乙醛,故D错误.
故选B.
点评 本题考查有机物的合成,为高频考点,侧重考查学生的分析能力,本题注意把握乙烯的性质以及反应类型的判断,把握官能团的变化以及反应条件,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 液态氟化氢分子间存在氢键,所以氟化氢的沸点比氯化氢高 | |
| B. | CH4、CO2、C2H2都是含有极性键的非极性分子 | |
| C. | [Cu(NH3)4]2+中含有离子键、极性键、配位键 | |
| D. | 因为非羟基氧原子数目逐渐减少,所以酸性HClO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
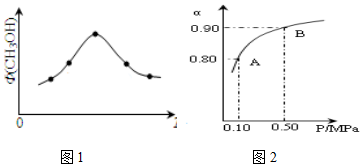 科学家为实现“低碳”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH).该反应的热化学方程式为:
科学家为实现“低碳”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH).该反应的热化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2与NaOH溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | F2与NaOH溶液反应:F2+4OH-═2F-+O2+2H2O | |
| C. | AgNO3溶液中加入少量氨水:Ag++2NH3•H2O═Ag(NH3)2++2H2O | |
| D. | Fe3O4与稀HNO3反应:Fe3O4+8H+═Fe2++2Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单气态氢化物的热稳定性:Y<W | |
| B. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| C. | Z和W的简单离子具有相同的电子层结构 | |
| D. | 化合物ZX2中既含有离子键,又含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径R>W>Y>Z | |
| B. | 气态氢化物稳定性:HmW<HnR | |
| C. | Z2Y2电子式可表示为  | |
| D. | RY2和W2均有漂白性,将两者等物质的量混合溶于水,漂白性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
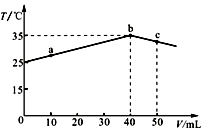
| A. | a→b的过程中,溶液中c(A-)与c(HA)之和始终不变 | |
| B. | b点表示酸碱恰好完全反应 | |
| C. | 等浓度的NaOH和NaA混合溶液中一定存在关系:c(Na+)>c(A-)>c(H+)>c(OH-) | |
| D. | 25℃时,HA的电离平衡常数Ka约为1.23×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气和水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 金属钠投入MgCl2溶液中:2Na+Mg2+═2Na++Mg | |
| C. | 0.1mol/LNaHSO4溶液与0.1mol/LBa(OH)2溶液等体积混合:SO42-+Ba2+=BaSO4↓ | |
| D. | 硅酸钠水溶液中通入过量CO2:SiO32-+2H2O+2CO2═2HCO3-+H2SiO3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com