
| ||
| ||
| △ |
| ||
| ||
| △ |
| ||
| △ |
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
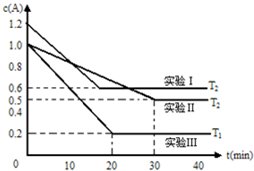 恒容体系,发生如下反应2A(g)?B(g)+xC(?)△H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如图(某课外活动小组一共进行了如图所示的三个实验,其中T1、T2表示不同的反应温度):
恒容体系,发生如下反应2A(g)?B(g)+xC(?)△H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如图(某课外活动小组一共进行了如图所示的三个实验,其中T1、T2表示不同的反应温度):| c(B)?c(C) |
| c2(A) |
| c(B)?c(C) |
| c2(A) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源:2015届安徽省高二上学期期中考试化学试卷(解析版) 题型:填空题
龙胆酸甲酯是制取抗心律失常药物——氟卡尼的中间体。
I.已知龙胆酸甲酯结构如右图 所示:
所示:
(1)龙胆酸甲酯的含氧官能团名称为 。
(2)下列有关龙胆酸甲酯的描述,不正确的是 (填字母)。
A.不能发生消去反应 B.难溶于水 C.与苯酚互为同系物 D.能与溴水反应 E.1 mol龙胆酸甲酯在镍催化下加氢最多需要4molH2 F.能与碳酸钠溶液反应产生二氧化碳
(3)龙胆酸甲酯与足量氢氧化钠溶液反应的化学方程式是 。(不用写反应条件)
II.已知X及其他几种有机物存在如下转化关系,且测得A中含三个甲基:
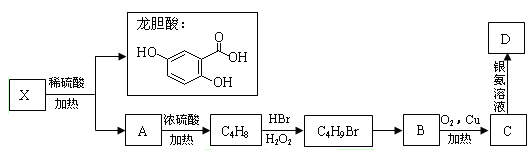
回答以下问题:
(4)X的结构简式为 ;C4H9Br的系统命名是 。
(5)写出下列反应的化学方程式(用结构简式表示),并在括号内指出反应类型:
C4H9Br→B ;( )
C→D 。 ( )
(6)写出满足下列条件的龙胆酸的一种同分异构体的结构简式 。
①能发生银镜反应 ②能使FeCl3溶液显色 ③酯类 ④苯环上的一氯代物只有两种
查看答案和解析>>
科目:高中化学 来源:海口模拟 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2009年海南省海口市高考调研化学试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com