
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(NO2)/mol•L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
| A. | 升高温度该反应的平衡常数K减小 | |
| B. | 20~40 s 内,v(N2O4)=0.004 mol•L-1•s1 | |
| C. | 反应达平衡时,吸收的热量为0.30 Q kJ | |
| D. | 100 s 时再通入0.40 mol N2O4,达新平衡时N2O4的转化率增大 |
分析 A.正反应为吸热反应,升高温度平衡正向移动,平衡常数增大;
B.根据v=$\frac{△c}{△t}$计算v(NO2),再利用速率之比等于其化学计量数之比计算v(N2O4);
C.80s时到达平衡,生成二氧化氮为0.3mol/L×2L=0.6mol,结合热化学方程式计算吸收的热量;
D.100 s 时再通入0.40 mol N2O4,等效为在原平衡的基础上增大压强,与原平衡相比,平衡逆向移动.
解答 解:A.正反应为吸热反应,升高温度平衡正向移动,平衡常数增大,故A错误;
B.20~40 s 内△v(NO2)=(0.2-0.12)mol/L=0.08mol/L,v(NO2)=$\frac{0.08mol/L}{40s-20s}$=0.004 mol•L-1•s1,速率之比等于其化学计量数之比,则v(N2O4)=$\frac{1}{2}$v(NO2)=0.002 mol•L-1•s1,故B错误;
C.80s时到达平衡,生成二氧化氮为0.3mol/L×2L=0.6mol,由热化学方程式可知吸收的热量为QkJ×$\frac{0.6mol}{2mol}$=0.3QkJ,故C正确;
D.100 s 时再通入0.40 mol N2O4,等效为在原平衡的基础上增大压强,与原平衡相比,平衡逆向移动,达新平衡时N2O4的转化率减小,故选D错误,
故选:C.
点评 本题考查化学平衡计算与影响因素、平衡常数等,D选项注意利用等效思想解答,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操 作 | 现 象 |
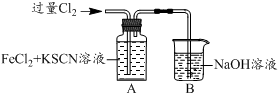 | I.A中溶液变红 II.稍后,溶液由红色变为黄色 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (或
(或
 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肉类富含蛋白质,属于碱性食物 | |
| B. | 碳酸氢钠可用于治疗胃酸过多 | |
| C. | 碘是人体必需的微量元素之一 | |
| D. | 食用富含维生素C的水果有益于身体健康 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH 溶液与FeCl3 溶液加足量稀硝酸 | |
| B. | Ba(OH)2 溶液与KNO3溶液加足量H2SO4 | |
| C. | CuSO4溶液与NaOH 溶液加足量稀盐酸 | |
| D. | BaCl2 溶液与Na2CO3 溶液加足量稀醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 参数 | 比较 | 解释 |
| A | 还原性 | Br->Cl- | 元素的非金属性越强,简单阴离子的还原性越弱 |
| B | 半径 | Na+<Mg2+<Al3+ | 同一周期粒子半径随原子序数的递增逐渐减小 |
| C | 酸性 | H2SO3>H2CO3 | 元素的非金属性越强,其含氧酸的酸性越强 |
| D | 沸点 | HF<HCl<HI | 组成结构相似的物质,相对分子质量越大沸点越高 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com