

| A. | b 电极的质量不变 | B. | b 电极是该装置的正极 | ||
| C. | a 电极上发生氧化反应 | D. | 电子由 b 电极经溶液流向 a 电极 |
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水,阳极产生22.4L气体时,电路中通过的电子数目为2NA | |
| B. | 1L0.1mol•L-1碳酸钠溶液中含有的氧原子数为0.3NA | |
| C. | 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| D. | 0.1 mol乙烯和乙醇的混合物完全燃烧所消耗的氧分子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
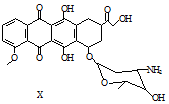
| A. | 每个X分子中含有5个手性碳原子 | |
| B. | 一定条件下,X能与乙醇发生酯化反应 | |
| C. | 一定条件下,X能发生消去反应 | |
| D. | X既能与盐酸反应,又能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 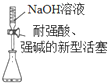 量取10.00mLNaOH溶液 | |
| B. | 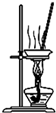 蒸干氯化铜溶液制CuCl2•2H2O | |
| C. | 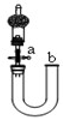 关闭活塞a,从b处加水,以检查装置的气密性 | |
| D. | 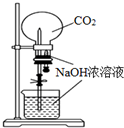 用CO2做喷泉实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
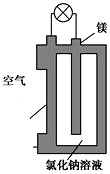 镁燃料电池作为一种高能化学电源,具有比能量高、使用安全方便、成本低、燃料易于贮运、污染小等特点,拥有良好的应用前景.如图是镁燃料电池的一种原理图,该装置为圆筒状,其中心为镁柱,圆筒为可透气的导电材料.下列有关该镁燃料电池的叙述正确的是( )
镁燃料电池作为一种高能化学电源,具有比能量高、使用安全方便、成本低、燃料易于贮运、污染小等特点,拥有良好的应用前景.如图是镁燃料电池的一种原理图,该装置为圆筒状,其中心为镁柱,圆筒为可透气的导电材料.下列有关该镁燃料电池的叙述正确的是( )| A. | 该电池的总反应为2Mg+O2═2MgO | |
| B. | 反应生成O2-,该离子有正极移向负极 | |
| C. | Cl-在阳极失去电子生成Cl2 | |
| D. | 正极反应式为O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,4.0g H218O与D2O的混合物中所含质子数、中子数均为2NA | |
| B. | 常温常压下,0.1mol/L Na2CO3溶液这所含CO32-的数目小于0.1NA | |
| C. | 用惰性电极电解CuSO4溶液,若电路中通过2NA个电子,则阳极产生11.2L气体 | |
| D. | 35℃时,1L pH=2的 H2SO4溶液中所含H+的数目和1L pH=12的NaOH溶液中所含的OH-的数目均为0.01NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气处理饮用水,在冬季的杀菌效果比在夏季好 | |
| B. | 中国古代利用明矾溶液的酸性来清除铜镜表面的铜锈 | |
| C. | 食盐、漂白粉均可以将某些病毒氧化而达到消毒的目的 | |
| D. | 白葡萄酒含维生素C等多种维生素,通常添加微量SO2,以防止营养成分被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
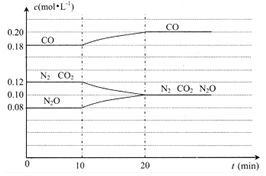 汽车尾气是导致雾霾天气的重要源头之一,其含有的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应.
汽车尾气是导致雾霾天气的重要源头之一,其含有的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应.| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(N2O) | n(CO) | n(CO2) | ||
| ① | 400 | 0.20 | 0.30 | 0.14 |
| ② | 500 | 0.10 | 0.40 | 0.080 |
| ③ | 500 | 0.30 | 0.20 | A |
| ④ | 600 | 0.60 | 0.40 | B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com