
【题目】“三室法”制备烧碱和硫酸示意图如下,下列说法正确的是( )
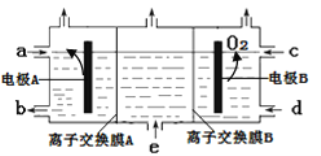
A.电极A为阳极,发生氧化反应
B.离子交换膜A为阴离子交换膜
C.稀硫酸从c处进,浓![]() 溶液从b处出,浓
溶液从b处出,浓![]() 溶液从e处进
溶液从e处进
D.![]() 和
和![]() 迁移的数量和等于导线上通过电子的数量
迁移的数量和等于导线上通过电子的数量
【答案】C
【解析】
根据题意和装置图,利用“三室法”制备烧碱和硫酸,则两个电极一边产生硫酸,一边产生烧碱,e处加入的应为硫酸钠溶液,钠离子与硫酸根离子通过离子交换膜A、B向两极移动,根据B电极上生成氧气,即电解质溶液中的氧元素,由-2价变为0价,化合价升高失电子,发生氧化反应,则电极B为阳极,硫酸根离子通过离子交换膜B向电极B移动,阳极反应为2H2O-4e-=O2↑+4H+,则c处加入的为稀硫酸,d处流出的为浓硫酸;电极A为阴极,Na+透过离子交换膜A向电极A移动,a加入的为稀氢氧化钠溶液,b流出的为浓氢氧化钠溶液,电极反应为2H2O+2e-=2OH-+H2↑,据此分析解答。
A.根据分析,电极A为阴极,发生还原反应,故A错误;
B.根据分析,Na+透过离子交换膜A向电极A移动,则离子交换膜A为阳离子交换膜,故B错误;
C.根据分析,稀硫酸从c处进,浓NaOH溶液从b处出,浓Na2SO4溶液从e处进,故C正确;
D.一个电子带一个单位的负电荷,Na+带一个单位的正电荷,硫酸根离子带两个单位的负电荷,Na+迁移的数量等于导线上通过电子的数量,导线上通过电子的数量等于硫酸根离子迁移数量的两倍,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】如图为反应2H2 (g)+O2(g)=2H2O(g)的能量变化示意图。下列说法正确的是( )
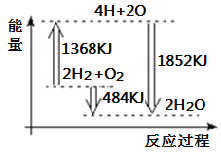
A. 由H、O原子形成2mol H2O(g),共吸收1852 kJ能量
B. 拆开2molH2 (g)和1mol O2 (g)中的化学键成为H、O原子,共放出1368kJ能量
C. 2molH2 (g)和1molO2 (g)反应生成2mol H2O(g),共放出484 kJ能量
D. 2molH2 (g)和1molO2 (g)反应生成2molH2O(l),共吸收484 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在恒容密闭容器中反应,可以作为达到平衡状态的标志是( )
2NO+O2在恒容密闭容器中反应,可以作为达到平衡状态的标志是( )
①单位时间内生成n mo1 O2的同时生成2nmol NO2
②单位时间内生成nmol O2的同时生成2nmolNO
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
A.①③⑤ B.②④⑤ C.①③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产、生活中广泛存在。
(1)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:
![]()
写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:

①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、C两点的浓度平衡常数关系:Kc(A)________Kc(C)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是________(填“A”或“B”或“C”)点。
③计算B点时该反应的压强平衡常数Kp(B)=________(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.核外电子的排布应优先排布在能量最低的电子层
B.对于主族元素而言,若最外层电子数为m,电子层数为n,则![]() 值越大,金属性越强
值越大,金属性越强
C.同一周期中,随着核电荷数的增加,阴离子半径逐渐增大
D.第三、四周期中,同族元素原子的核电荷数相差一定为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁盐、铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用,现用铁屑与硫酸反应制备硫酸亚铁。
已知:①4Fe2++O2+4H+===4Fe3++2H2O
②硫酸亚铁在水中的溶解度如下图:
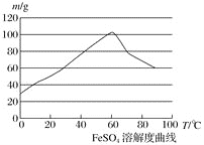
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。此步骤中,分离出液体的方法通常不用过滤,使用的操作是____________(填写操作名称)。
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得硫酸亚铁溶液。
①硫酸浓度应选择(填字母序号)__________;
A.浓硫酸 B.10 moL·L-1硫酸
C.3 moL·L-1硫酸 D.任意浓度硫酸
②温度宜控制在________,加热的同时需适当补充水,原因是___________________;
③反应中应保持![]() _________ (填“<”“>”或“=”) 1。
_________ (填“<”“>”或“=”) 1。
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在,如“摩尔盐”,即(NH4)2SO4·FeSO4·6H2O(硫酸亚铁铵),就是在硫酸亚铁溶液中加入少量稀硫酸溶液,再加入饱和硫酸铵溶液,经过_______、_______、_______、_______等一系列操作后所得。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25时℃,0.2 mol/L的HF溶液中存在下述平衡:HF![]() H++F-。加一定量的蒸馏水,平衡将____(填“正向”、“逆向”或“不”)移动,溶液中的c(H+)将___(填“增大”、“减小”或“不变”);加入少量0.2mol/L的盐酸,能___(填“促进”或“抑制”)HF的电离,HF的电离平衡常数K将___(填“增大”、“减小”或“不变”);
H++F-。加一定量的蒸馏水,平衡将____(填“正向”、“逆向”或“不”)移动,溶液中的c(H+)将___(填“增大”、“减小”或“不变”);加入少量0.2mol/L的盐酸,能___(填“促进”或“抑制”)HF的电离,HF的电离平衡常数K将___(填“增大”、“减小”或“不变”);
(2)下列物质属于电解质的是____;属于非电解质的是____;能导电的物质是____;其水溶液能够导电的物质____。
①CO2 ②铜 ③烧碱 ④NH3.H2O ⑤石墨 ⑥碳酸钠 ⑦CH3COOH ⑧蔗糖 ⑨氯气 ⑩盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确称取6.0 g铝土矿样品(主要成分为Al2O3,含Fe2O3杂质),加入100 mL稀硫酸中,充分反应后向滤液中加入10 mol·L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如图所示。则所用硫酸物质的量浓度为( )

A. 3.50 mol·L-1
B. 1.75 mol·L-1
C. 0.85 mol·L-1
D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下一种烷烃A和一种单烯烃B组成混合气体,A或B分子最多只含有4个碳原子,且B分子的碳原子数比A分子的多。
(1)将该混合气体1L充分燃烧在同温、同压下得2.5LCO2,试推断原混合气体A中和B所有可能的组合及其体积比___。
(2)120℃时取1L该混合气体与9L氧气混合,充分燃烧后,当恢复到120℃和燃烧前的压强时,体积增大6.25%,试通过计算确定混合气中各成分的分子式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com