
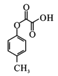
【题目】苯酚是一种很有价值的化工原料,年产量可达几百万吨。苯酚可合成著名的解热镇痛药——阿司匹林,也可合成聚碳酸酯,其合成路线如下:

(1)阿司匹林分子中的含氧官能团名称为_______;G的化学名称是____。
(2)E为饱和一元酮,其结构简式为________;H和K合成聚碳酸酯的反应类型是_____。
(3)鉴别G和阿司匹林的一种显色试剂为___________
(4)已知K的相对分子质量为99,其分子式为____________
(5)写出阿司匹林与足量NaOH溶液反应的化学方程式_________
(6)写出能同时满足以下条件的阿司匹林的两种异构体的结构简式_______________
①苯环上只有两种一氯代物;②含有羧基;③水解产生酚。
【答案】酯基、羧基 2-羟基苯甲酸或2-羟基-1-苯甲酸或邻羟基苯甲酸 ![]() 缩聚反应 FeCl3溶液 COCl2
缩聚反应 FeCl3溶液 COCl2 ![]() +3NaOH→CH3COONa+
+3NaOH→CH3COONa+![]() +2H2O
+2H2O ![]() 、
、 、
、 、
、![]() 、
、![]()
【解析】
苯酚与NaOH反应产生苯酚钠![]() ,然后与CO2在一定温度、压强下反应产生
,然后与CO2在一定温度、压强下反应产生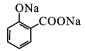 ,再用硫酸酸化得到G为
,再用硫酸酸化得到G为 ;G与D(
;G与D(![]() )发生取代反应产生阿司匹林:
)发生取代反应产生阿司匹林: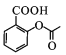 和CH3COOH;苯酚与E反应,然后经HCl酸化产生J:
和CH3COOH;苯酚与E反应,然后经HCl酸化产生J: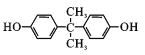 ,题给信息可知,其为饱和一元酮,则E是丙酮,结构简式为
,题给信息可知,其为饱和一元酮,则E是丙酮,结构简式为![]() ,
, 与NaOH混合加热,变为H:
与NaOH混合加热,变为H: ,H与K在酸性条件下发生缩聚反应得到聚碳酸酯:
,H与K在酸性条件下发生缩聚反应得到聚碳酸酯: ,逆推可知K是COCl2,然后根据问题分析解答。
,逆推可知K是COCl2,然后根据问题分析解答。
根据上述分析可知:G是 ,E是
,E是![]() ,H是
,H是 ,K是COCl2。
,K是COCl2。
(1)根据阿司匹林结构简式 可知其中含氧官能团名称为酯基、羧基;G是
可知其中含氧官能团名称为酯基、羧基;G是 ,名称为邻羟基苯甲酸或2-羟基苯甲酸或2-羟基-1-苯甲酸;
,名称为邻羟基苯甲酸或2-羟基苯甲酸或2-羟基-1-苯甲酸;
(2)E为饱和一元酮,根据苯酚与J结构的区别,可知E为丙酮,其结构简式为![]() ;H是
;H是 ,K是COCl2,H和K发生缩聚反应合成聚碳酸酯,同时产生NaCl;
,K是COCl2,H和K发生缩聚反应合成聚碳酸酯,同时产生NaCl;
(3)G是邻羟基苯甲酸,含有酚羟基,遇FeCl3溶液显紫色,而阿司匹林无酚羟基,所以鉴别G和阿司匹林的一种显色试剂为FeCl3溶液;
(4)根据上述推断可知K是COCl2;
(5)阿司匹林与足量NaOH溶液反应,-COOH变为-COONa,酯基变为-ONa和CH3COONa,同时产生水,反应的化学方程式为:![]() +3NaOH→CH3COONa+
+3NaOH→CH3COONa+![]() +2H2O;
+2H2O;
(6)同分异构体分子式相同,结构不同,阿司匹林的同分异构体满足条件:①苯环上只有两种一氯代物;说明有处于苯环上对位的2个取代基;②含有羧基;③水解产生酚,该取代基是酚羟基形成的酯基,则符合条件的同分异构体可能结构为:![]() 、
、 、
、 、
、![]() 、
、![]() 。
。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,对可逆反应A(g)+2B(g)![]() 3C(g)的下列叙述中,能说明反应已达到平衡的是( )
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A. C生成的速率与C分解的速率相等
B. 单位时间内消耗amolA,同时生成3amolC
C. 容器内的压强不再变化
D. 混合气体的物质的量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在120℃时,某混合烃和过量O2在一密闭容器中完全反应,测知反应前后的压强没有变化,则该混合烃可能是
A.CH4和C2H4B.C2H2和C2H4C.C2H4和C2H6D.C3H4和C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法一定正确的是
A.0.5molNO与0.5molO2充分反应后分子数少于0.75NA
B.5.6gFe在发生氧化还原反应时失去电子数为0.2NA
C.1.0L0.1mol/LAl2(SO4)3溶液中阳离子数目为0.2NA
D.agC2H4和C3H6混合物完全燃烧时消耗O2的体积为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙炔与甲苯为主要原料,按下列路线合成一种香料W:

(1)写出实验室制备乙炔的化学方程式___________。
(2)反应①的反应试剂、条件是________,上述①~④反应中,属于取代反应的是________。
(3)写出反应③的化学方程式_____________。
(4)检验反应③是否发生的方法是_______。
(5)写出两种满足下列条件的![]() 同分异构体的结构简式______。
同分异构体的结构简式______。
a.能发生银镜反应 b.苯环上的一溴代物有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以工业钴渣为原料制取CoSO4溶液和ZnSO4·7H2O晶体,其实验流程如下:
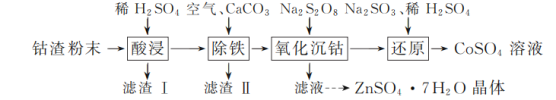
已知:①“酸浸”所得溶液中主要含CoSO4、ZnSO4,另含少量FeSO4、NiSO4。②金属活动性:Ni介于Fe、Cu之间。③下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度1 mol·L-1计算,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-):
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Co2+ | 7.6 | 9.4 |
Zn2+ | 5.9 | 8.9 |
(1)“酸浸”时所加稀硫酸不宜过量太多的原因是________。
(2)“除铁”时,向溶液中持续鼓入空气的作用是________。
(3)流程中需将滤渣Ⅰ、滤渣Ⅱ的洗涤液与“除铁”后所得滤液合并,目的是________。
(4)写出“还原”过程中Na2SO3、稀H2SO4与Co(OH)3反应的离子方程式:________。
(5)实验所得CoSO4溶液可用于制备CoCO3,制备时CoSO4饱和溶液与Na2CO3饱和溶液的混合方式为________。
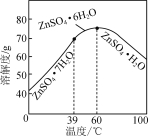
(6)请结合如图硫酸锌晶体的溶解度曲线,设计从“氧化沉钴”后的滤液(含ZnSO4、Na2SO4、NiSO4等)中获取ZnSO4·7H2O的实验方案:取适量滤液,____________________________,过滤,用少量冰水洗涤,低温干燥得ZnSO4·7H2O晶体。(实验中须使用的试剂有:Zn粉、1.0 mol·L-1 NaOH、1.0 mol·L-1 H2SO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下,下列叙述正确的是( )

A. 反应①中试剂X是氢氧化钠溶液
B. 反应①过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应中包含一个氧化还原反应
D. 将试剂X和Y进行对换,最终可以达到相同的效果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】提供几组常见的实验装置示意图,下列有关叙述正确的是

A.装置①中阳极上有无色无味气体冒出
B.装置②中的铜片应与直流电源的负极相连
C.装置③中,若电解液为KOH溶液,则电极a的反应式:H2-2e-+2OH-=2H2O
D.装置④阳极减少的质量一定等于阴极增加的质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3),又名大苏打、海波,它是无色透明的单斜晶体,熔点48℃。硫代硫酸钠(Na2S2O3)可作为照相业的定影剂,反应原理为AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr。
Ⅰ.为了从废定影液中提取 AgNO3,设计如下实验流程。
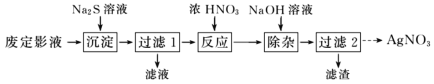
(1)“沉淀”步骤中生成 Ag2S 沉淀,检验沉淀完全的操作是________。
(2)“反应”步骤中会生成淡黄色固体,该反应的化学方程式为________。
(3)“过滤 2”的溶液获取 AgNO3晶体的操作是蒸发浓缩、冷却结晶、________、________、干燥。
Ⅱ.下图是实验室模拟工业制备 Na2S2O3 的装置图。
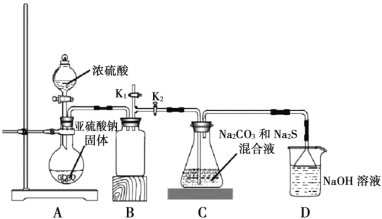
依据图示回答下列问题:
(4)装置 A 中盛放亚硫酸钠固体的玻璃仪器名称是________,装置 B 的作用是________。
(5)分液漏斗中如直接用 98%的浓硫酸,烧瓶中固体易产生“结块”现象,使反应速率变慢。产生“结块”现象的原因是________。
(6)设置 K1导管的目的是为了防止拆除装置时造成空气污染。请简述操作方法________。
(7)硫代硫酸钠还可用于除去鞣制皮革时过量的重铬酸盐,将其还原成 Cr3+,理论上处理1mol Cr2O72-需要 Na2S2O3的质量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com