
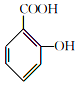
 +
+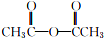 $→_{75-80℃}^{H_{3}PO_{4}}$
$→_{75-80℃}^{H_{3}PO_{4}}$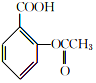 +CH3COOH
+CH3COOH| 名称 | 式量 | 性质 | 熔点/℃ | 沸点/℃ | 溶解度 | ||
| 水 | 乙醇 | 乙酸乙酯 | |||||
| 水杨酸 | 138 | 白色结晶粉末、无臭 | 157~159 | 211 | 溶 | 易溶 | 易溶 |
| 醋酸酐 | 102 | 无色液体、易燃、有醋酸味 | -73.1 | 138.6 | 易溶 | 溶 | 易溶 |
| 乙酸水杨酸 | 180 | 白色针状结晶 | 135 | 321.4 | 冰水微溶、热水可溶 | 易溶 | 微溶 |
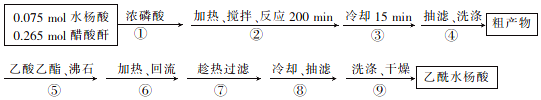
分析 醋酸酐和水杨酸混合,然后向混合溶液中加入浓磷酸,相当于浓磷酸的稀释,并不断搅拌,防止局部受热而产生安全事故;摇匀后加热,然后冷却、过滤、水洗得到粗产品,然后向粗产品中加入乙酸乙酯,加热回流,趁热过滤、冷却、抽滤、洗涤、干燥得到乙酰水杨酸,
(1)浓磷酸与浓硫酸的作用类似;根据反应分析;
(2)根据表中的溶解度分析;
(3)测定产品熔点可验证产品是否纯净;
(4)水杨酸反应完全,根据不足量的物质计算理论产量,进而计算产率.
解答 解:(1)浓磷酸作催化剂;由反应可知步骤②的加热方式为水浴加热,温度在75~80℃;
故答案为:催化剂;75~80;
(2)由表可知乙酸乙酯可溶解水杨酸和醋酸酐等杂质,乙酰水杨酸微溶于乙酸乙酯,同时减少乙酰水杨酸因溶解而造成的损失;
故答案为:溶解水杨酸和醋酸酐等杂质,同时减少乙酰水杨酸因溶解而造成的损失;
(3)测定产品熔点与恒定熔点比较可以验证最后得到的乙酰水杨酸产品较为纯净;
故答案为:测定产品熔点;
(4)0.075mol水杨酸与0.265mol醋酸酐反应,由于醋酸酐的物质的量大于水杨酸,所以得到的乙酰水杨酸应该按照水杨酸来计算,故理论上得到乙酰水杨酸的质量为0.075mol×180g/mol=13.5g,所以乙酰水杨酸的产率为(8.91g÷13.5g)×100%=66%,反应温度没有控制好、粗产品回流时的温度过高,造成产品水解发生副反应等造成产率低;
故答案为:66%;反应温度没有控制好(或粗产品回流时的温度过高,造成产品水解发生副反应等).
点评 本题考查物质制备实验方案设计,明确实验原理及基本操作方法是解本题关键,知道每一步的实验目的,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 通常情况下氯气呈黄绿色,有刺激性气味,极易溶于水 | |
| B. | 氯气能够杀菌,常用于居室消毒 | |
| C. | 红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 | |
| D. | 把集气瓶小心地放在鼻孔下直接闻氯气的气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甘油作护肤保湿剂是因为甘油有还原性 | |
| B. | 服用铬含量超标的药用胶囊会对人对健康造成危害 | |
| C. | “血液透析”利用了胶体的性质 | |
| D. | 葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验内容 | 实验现象 | 相关解释 | |
| A | 往Fe(OH)3胶体中逐滴滴入稀盐酸 | 先出现红褐色沉淀,后沉淀溶解 | 先胶体聚沉,后Fe(OH)3溶解 |
| B | NH3与Cl2混合 | 生成白烟 | NH3与Cl2发生化合反应生成NH4Cl |
| C | 等量的Cu分别与等体积足量的浓硝酸和稀硝酸反应 | 浓硝酸反应后呈绿色,稀硝酸反应后呈蓝色 | c(Cu2+)不同 |
| D | 加热硝酸铜固体,将带火星的木条伸入所得的气体中 | 生成红棕色气体,带火星木条复燃 | NO2有助燃性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

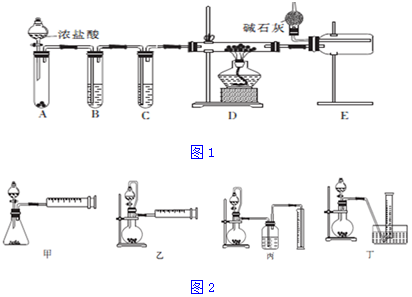
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
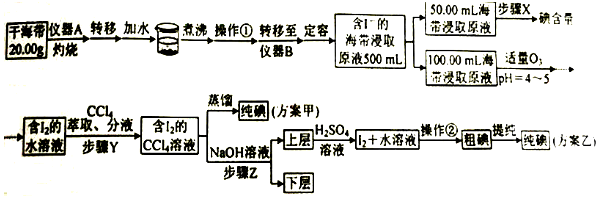
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 操作及现象 | 结论 | |
| A | 向PbSO4悬浊液中加入KI溶液时出现黄色沉淀 | Ksp(PbI2)<Ksp(PbSO4) |
| B | 向某溶液中滴加氯水后再加入稀C6H5OH溶液,溶液呈红色 | 原溶液中可能含有Fe2+ |
| C | 向Na2SiO3溶液中通入过量SO2气体 | 反应为:SiO${\;}_{3}^{2-}$+SO2+H2O=H2SiO3↓+SO${\;}_{3}^{2-}$ |
| D | 将氢气还原氧化铜所得的红色固体加入足量稀硝酸中,溶液变为蓝色 | 反应为:3Cu+2NO${\;}_{3}^{-}$+8H+=3Cu2++2NO↑+4H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
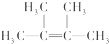 名称为2,3-二甲基-2-丁烯.
名称为2,3-二甲基-2-丁烯.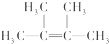 +Br2→
+Br2→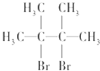 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com