
分析 (1)相同条件下,酸的电离平衡常数越大,其电离程度越大,则酸根离子的水解程度越小,溶液的碱性越弱;
(2)根据平衡可知当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变;
(3)根据Na2CO3在溶液中的行为来分析:Na2CO3 =2Na++CO32-;
CO32-+H2O?HCO3-+OH-;
HCO3-+H2O?H2CO3+OH-;
H2O?H++OH-;
根据溶液呈电中性来分析;根据由水电离出的氢离子和氢氧根永远相等来分析;
(4)当溶液中Cl-完全沉淀时,即c(Cl-)=1.0×10-5mol/L,依据Ksp(AgCl)=2.0×10-10,计算得到c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$,依据计算得到的银离子浓度和溶度积常数计算此时溶液中c(CrO42-)=$\frac{Ksp(A{g}_{2}Cr{O}_{4})}{{c}^{2}(A{g}^{+})}$.
解答 解:(1)草酸的第二步电离平衡常数大于碳酸的第二步电离平衡常数,电离平衡常数越小,其酸根离子的水解程度越大,所以碳酸根离子的水解程度大于草酸根离子,导致草酸钠的pH小于碳酸钠;酸的电离平衡常数越大,其电离程度越大,溶液酸性越强;
故答案为:大于;草酸;
(2)根据平衡可知当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变,
故答案为:当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变;
(3)Na2CO3在溶液中的行为来分析:Na2CO3 =2Na++CO32-;
CO32-+H2O?HCO3-+OH-;
HCO3-+H2O?H2CO3+OH-;
H2O?H++OH-;
溶液呈电中性可知:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-),故答案为:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-);
Na2CO3本身不含氢离子和氢氧根,故溶液中所有的氢原子和氢氧根均来自于水且相等,故有:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-),
故答案为:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-);
(4)当溶液中Cl-完全沉淀时,即c(Cl-)=1.0×10-5mol/L,依据Ksp(AgCl)=2.0×10-10,计算得到c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=$\frac{2.0×1{0}^{-10}}{1.0×1{0}^{-5}}$=2.0×10-5mol/L
此时溶液中c(CrO42-)=$\frac{Ksp(A{g}_{2}Cr{O}_{4})}{{c}^{2}(A{g}^{+})}$=$\frac{2.0×1{0}^{-12}}{(2.0×1{0}^{-5})^{2}}$=5.0×10-3mol/L,
故答案为:2.0×10-5 ;5.0×10-3.
点评 本题考查化学反应原理的分析与探究、弱电解质的电离和盐类水解、缓冲溶液、电解质溶液中的电荷守恒和质子守恒以及有关溶度积的计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 某固体加入稀盐酸,产生了无色气体,证明该固体中一定含有CO32- | |
| B. | 某溶液中滴加BaCl2溶液后,生成不溶于稀HNO3的白色沉淀,该溶液中一定含有SO42- | |
| C. | 某溶液中滴加Ba(OH)2溶液后,生成白色沉淀,该溶液中一定含有SO42- | |
| D. | 要证明烧碱溶液中是否含有氯离子,先加硝酸除去OH-,再加硝酸银溶液,有白色沉淀出现,证明含有氯离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过程中银器一直保持恒重 | |
| B. | 银器为正极,Ag2S 被还原生成单质银 | |
| C. | 铝质容器为正极 | |
| D. | 黑色褪去的原因是黑色 Ag2S 转化为白色 AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白磷应放在冷水中保存 | B. | 将水注入浓硫酸中以稀释浓硫酸 | ||
| C. | 硝酸银放在无色试剂瓶中保存 | D. | 在蒸发皿中加热分解氯酸钾固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,含有 NA个氮原子的氮气体积约为 11.2L | |
| B. | 标准状况下,64gSO2中含有的原子数为 3NA | |
| C. | 在常温常压下,11.2L Cl2含有的分子数为 0.5NA | |
| D. | 标准状况下,11.2L H2O 含有的分子数为 0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
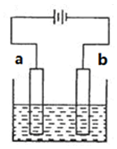
| A. | 精炼铜时,a极为粗铜,b极为精铜 | |
| B. | 电镀铜时,a极为镀件,b极为铜 | |
| C. | 保护铁时,a极为铁片,b极为锌片 | |
| D. | 惰性电极电解饱和食盐水时,b极有黄绿色气体产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com