
【题目】由锌、铁、铝、镁四种金属的两种组成的混合物10克,与足量的盐酸反应产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是( )
A. 锌 B. 铁 C. 铝 D. 镁
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】以干海带为原料提取碘单质和氯化钾的过程主要分三步:完成下列填空:
(1)步骤一:灼烧干海带,使其灰化后用热水浸泡、过滤,制得原料液,含有氯化钾等物质.实验室灼烧海带应放在(填写仪器名称)中加热,选用热水而不是冷水浸泡海带灰的目的是 .
(2)步骤二:原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I﹣ , 制得富碘溶液.实验室模拟氧化过程的实验装置如图所示.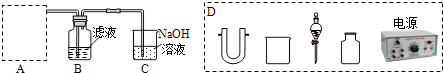
装置中A部分用于制取氯气,实验室制取氯气通常有两种方案:一是在强酸性条件下用氧化剂氧化Cl﹣;二是电解法.限用图D中的仪器(支撑仪器、导管、导线、石墨棒和橡皮塞除外),能实现的反应是(选填编号).
a.2NaCl(s)+MnO2+2H2SO4(浓) ![]() MnSO4+Cl2↑+Na2SO4+2H2O
MnSO4+Cl2↑+Na2SO4+2H2O
b.2KMnO4+16HCl(浓)→2MnCl2+2KCl+5Cl2↑+8H2O
c.2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
d.4HCl(浓)+MnO2 ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
广口瓶B中发生反应的离子方程式是 . 装置C中NaOH的作用是 .
(3)步骤三:取100mL B中富碘溶液,按如下流程分离碘单质.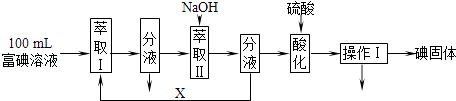
萃取Ⅱ和酸化过程发生的反应分别是:
3I2+6OH﹣→5I﹣+IO3﹣+3H2O;
5I﹣+IO3﹣+6H+→3I2+3H2O;
萃取剂X应选择(选填编号).
a.100mL苯b.10mL乙醇c.10mLCCl4d.10mL己烯
实验室进行萃取操作的仪器是 . 操作Ⅰ的名称是 .
(4)分离出的KCl样品中常含有少量NaCl和K2CO3等物质,设计实验用沉淀法测定氯化钾样品中K2CO3的质量分数:①要用到的化学试剂是(填写化学式);
②要测定的物理量是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+ ![]() O2(g)=CO(g);△H=﹣393.5 kJ/mol
O2(g)=CO(g);△H=﹣393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(g);△H=+571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=﹣890.3 kJ
D.![]() C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=﹣1400 kJ/mol
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=﹣1400 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以烯烃为原料可以合成多种高聚物的合成路线如下:
已知:烯烃和X2在一定条件下能发生取代,且能发生双烯合成如 ![]() .
.
请回答下列问题:
(1)X中含有的官能团为;
(2)Y→Z的化学方程式为;
(3)高聚物E的结构简式为;甲是A的一种同分异构体,其能实现转化: ![]() ,甲的名称为;
,甲的名称为;
(4)由 ![]() 可以合成
可以合成 ![]() .按合成路线的顺序,涉及反应的反应类型有: .
.按合成路线的顺序,涉及反应的反应类型有: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生反应:2A(g)+B(g)2C(g),经2s后测得C的浓度为0.6molL﹣1 , 下列几种说法中正确的是( )
A.用物质A表示反应的平均速率为0.3 molL﹣1s﹣1
B.用物质B表示反应的平均速率为0.3 molL﹣1s﹣1
C.2 s时物质A的转化率为70%
D.2 s时物质B的浓度为0.3 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是 ( )
A. 氨气通入稀硫酸中:NH3+H+=NH4+
B. 二氧化碳通入碳酸钠溶液中:CO2+CO![]() +H2O=2HCO3-
+H2O=2HCO3-
C. 磁性氧化铁与浓盐酸反应:Fe3O4+8H+===Fe2++2Fe3++4H2O
D. 澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO![]() ===CaCO3↓+H2O
===CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物).
请填写下列空白: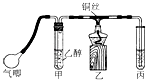
(1)检验乙醛的试剂是;(选填编号)
a.银氨溶液 b.碳酸氢钠溶液 c.新制氢氧化铜 d.氧化铜
乙醇发生催化氧化的化学反应方程式为;
(2)实验开始时,是先鼓入空气还是先点燃酒精灯加热铜丝? , 原因是;该实验中“鼓气速度”这一变量你认为可用来估量;
(3)实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是 . 以下实验需要水浴加热的是;(选填编号)
a.卤代烃水解 b.银镜反应 c.乙酸丁酯 d.苯的硝化反应
(4)该课外活动小组偶然发现向溴水中加入乙醛溶液,溴水褪色(假设两者恰好完全反应).该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应.请你设计一个简单的实验,探究哪一种猜想正确? .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成下面问题:
(1)青蒿素结构如图 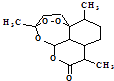 ,有关叙述正确的是(选填序号). a.化学式为C15H21O5 b.不能与NaOH溶液反应
,有关叙述正确的是(选填序号). a.化学式为C15H21O5 b.不能与NaOH溶液反应
c.易溶于水 d.含有过氧键,有较强氧化性
(2)由青蒿酸为原料出发,经五步合成可得到青蒿素.其中第2步为还原反应: 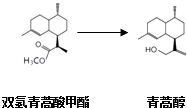 常温下即可反应且略放热,还原剂为LiAlH4 . 相关物质的性质:
常温下即可反应且略放热,还原剂为LiAlH4 . 相关物质的性质:
物质 | 性质 |
双氢青蒿酸甲酯(C16H28O2) | 固体,难溶于水,易溶于有机溶剂. |
青蒿醇(C15H28O) | 固体,难溶于水,易溶于有机溶剂. |
乙醚 | 无色液体,微溶于水;密度0.71g/cm3;沸点:34.6℃. |
氢化铝锂 | 固体,溶于乙醚.与水反应:LiAlH4+4H2O→Al(OH)3↓+LiOH+4H2↑可将一分子酯还原成二分子醇,自身生成醇铝、醇锂.(醇铝、醇锂可与盐酸反应,生成铝盐、锂盐和相应的醇). |
某学习小组在实验室用双氢青蒿酸甲酯制取青蒿醇.
①反应中使用过量的氢化铝锂,理由是 . 为使反应在溶液状态下进行,可用乙醚为溶剂,不用水的理由是 .
②请设计实验室制备装置(画出草图):
(3)该反应有机物的转化率约为96%,所得乙醚溶液中含有醇锂、醇铝、双氢青蒿酸甲酯、氢化铝锂.从反应混合物中提取青蒿醇的方法是:①加后分液;
②从乙醚层提取青蒿醇.有多种方法,以下是二种方案:
方案一:蒸发结晶. 方案二:蒸馏析出晶体.
a.这2个方案在析出晶体后都应有残留液,原因是 .
b.请对这2个方案进行比较 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物  ,下列说法不正确的是( )
,下列说法不正确的是( )
A.有顺反异构
B.可以和浓溴水发生取代反应和加成反应
C.可以发生加聚反应、水解反应和消去反应
D.1mol该化合物最多能与4 mol H2发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com