
| 实验编号 | 1 | 2 | 3 | 4 |
| V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 1.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
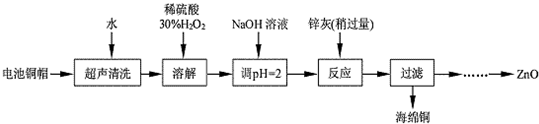
分析 废弃旧电池的铜帽加水超声洗涤去除表面的可溶性杂质,然后加入稀硫酸和双氧水,双氧水具有强氧化性,能在酸性条件下氧化铜生成铜盐,加入氢氧化钠降低酸性,然后加入足量的锌灰,由于锌的活泼性强于铜,故能把铜从其盐溶液中置换出来,剩余锌的化合物制备ZnO,
(1)酸性条件下Cu与过氧化氢发生氧化还原反应生成硫酸铜和水;
(2)①根据淀粉与碘单质作用变蓝解答;
②根据题中数据可知,第一次数据偏差较大,为偶然误差,应去掉,所以Na2S2O3标准溶液的体积为$\frac{25.31+25.30+25.32}{3}$mL=25.31mL,则消耗的Na2S2O3的物质的量为0.1000mol/L×0.02531L=0.002531Lmol,根据反应2Cu2++4I-═2CuI(白色)↓+I2、2S2O32-+I2═2I-+S4O62-得关系式2Cu2+~I2~2S2O32-,根据关系可求得铜元素的质量,进而确定铜的质量分数,若滴定前溶液中的H2O2没有除尽,则加入碘离子后双氧水氧化碘离子产生的碘单质,会导致Na2S2O3标准溶液消耗偏大,据此分析;
(3)常温下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成氢氧化铜沉淀,溶液中剩余的氢氧化钠的物质的量浓度为$\frac{50mL×0.00022mol/L-2×50mL×0.0001mol/L}{100mL}$=0.00001mol/L,根据c(Cu2+)=$\frac{K{\;}_{SP[Cu(OH)_{2}]}}{c{\;}^{2}(OH{\;}^{-})}$进行计算;
(4)滴加H2O2溶液,使Fe2+转化完全为Fe3+,滴加NaOH溶液,形成氢氧化铁沉淀,除杂后形成氢氧化锌沉淀,过滤、洗涤、干燥900℃煅烧制得氧化锌.
解答 解:(1)因为双氧水在酸性溶液中先把铜氧化成氧化铜,当然这是一个微弱的反应,形成一个平衡,但是形成的氧化铜马上就会被稀硫酸溶解,平衡被打破,反应朝正方向进行,故而逐渐溶解,反应的离子方程式为:Cu+H2O2+2H+=Cu2++2H2O;
故答案为:Cu+H2O2+2H+=Cu2++2H2O;
(2)①淀粉溶液为指示剂,当最后一滴Na2S2O3溶液滴入时,溶液蓝色褪去,半分钟颜色不变,说明滴定到达终点,
故答案为:淀粉溶液;蓝色褪去;
②根据题中数据可知,第一次数据偏差较大,为偶然误差,应去掉,所以Na2S2O3标准溶液的体积为$\frac{25.31+25.30+25.32}{3}$mL=25.31mL,则消耗的Na2S2O3的物质的量为0.1000mol/L×0.02531L=0.002531mol,根据反应2Cu2++4I-═2CuI(白色)↓+I2、2S2O32-+I2═2I-+S4O62-得关系式2Cu2+~I2~2S2O32-,根据关系可求得铜元素的质量为0.002531mol×$\frac{100}{20}$×64g/mol=0.8099g,所以铜的质量分数为$\frac{0.8099}{1}$×100%=80.99%,若滴定前溶液中的H2O2没有除尽,则加入碘离子后双氧水氧化碘离子产生的碘单质,会导致Na2S2O3标准溶液消耗偏大,则所测定c (Cu2+)将会偏大,
故答案为:80.99%;偏大;
(3)常温下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成氢氧化铜沉淀,溶液中剩余的氢氧化钠的物质的量浓度为$\frac{50mL×0.00022mol/L-2×50mL×0.0001mol/L}{100mL}$=0.00001mol/L,所以c(Cu2+)=$\frac{K{\;}_{SP[Cu(OH)_{2}]}}{c{\;}^{2}(OH{\;}^{-})}$=$\frac{2.0×10{\;}^{-20}}{0.0000{1}^{2}}$mol/L=2×10-10mol/L,
故答案为:2×10-10;
(4)由除去铜的滤液制备ZnO 的实验步骤依次为:①①向滤液中加入30%H2O2,使其充分反应,目的使Fe2+转化完全为Fe3+;②滴加NaOH溶液,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全,③过滤,④向滤液中滴加1.0mol•L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全,⑤过滤、洗涤、干燥;⑥900℃煅烧,制得氧化锌,
故答案为:滴加1.0mol•L-1NaOH,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;向滤液中滴加1.0mol•L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全.
点评 本题主要考查实验室废弃旧电池的铜帽回收铜和制备ZnO,考查学生对综合实验处理能力,注意实验方案的设计原理和步骤是解答的关键,平时注意打好扎实的基础知识和灵活应用知识解决问题的能力培养,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 | |
| B. | 正极为Cu,负极为Fe,电解质溶液为Fe(NO3)2溶液 | |
| C. | 正极为Fe,负极为Cu,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为Ag,负极为Zn,电解质溶液为CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把浑浊的液体倒入蒸发皿中加热 | B. | 开始析出晶体后用玻璃棒搅拌 | ||
| C. | 待水分完全蒸干后停止加热 | D. | 蒸发皿中出现多量固体时停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | H2(g) | A2(g) | B2(g) | HA(g) | HB(g) |
| 能量(kJ) | 436 | a | 193 | 432 | 366 |
| A. | 能量最高的分子是H2 | B. | 最稳定的分子是B2 | ||
| C. | a=243 | D. | HB(g)+A2(g)═B2(g)+HA(g) 是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应在40 min内的平均速率可表示为 ν(NH3)=0.001 mol/L•min | |
| B. | 该反应达到平衡时,保持其他条件不变,容器中NH3、N2、H2的物质的量保持相等 | |
| C. | 其他条件不变,升高温度,可使该反应的速率加快 | |
| D. | 达到平衡时,ν(NH3)=ν(N2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 朝鲜第三次核试验产生的放射性物质的衰变为化学变化 | |
| B. | 燃烧化石燃料排放的废气中含大量CO2、SO2,形成酸雨 | |
| C. | 为防止垃圾污染城市,可采用露天焚烧或深埋的方法进行处理 | |
| D. | 用高纯度二氧化硅制作的光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷与氯气在光照条件下发生加成反应 | |
| B. | 甲烷和乙烯都可以与氯气反应,反应类型不同 | |
| C. | 蔗糖、油脂、蛋白质都可以水解 | |
| D. | 乙醇能够被酸性的高锰酸钾溶液直接氧化成乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加KI溶液时,转移2 mol e-时生成 1 mol白色沉淀 | |
| B. | 通入SO2后溶液逐渐变成无色,体现了 SO2的漂白性 | |
| C. | 通入SO2时,SO2与I2反应,I2作还原剂 | |
| D. | 上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
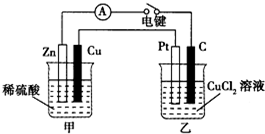 某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合装置的电键时,观察到电流表的指针发生了偏转.请回答下列问题:
某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合装置的电键时,观察到电流表的指针发生了偏转.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com