
| A. | 1:1 | B. | 1:2 | C. | 2:3 | D. | 5:6 |
分析 第一份钠先与硫酸,钠的物质的量为:$\frac{13.8g}{23g/mol}$=0.6mol,生成氢气都是0.3mol,消耗硫酸0.2mol,同时生成0.2mol的氢氧化钠,10.8gAl物质的量为0.4mol,与铝反应生成0.3mol的氢气,所以第一份共产生氢气的物质的量为:0.3mol+0.3mol=0.6mol;而第二份10.8g物质的量为0.4mol,完全反应所需氢氧化钠的物质的量为:0.4mol,而氢氧化钠的总物质的量为:0.6+0.2=0.8mol,所以氢氧化钠过量,则钠与水产生氢气的量为:0.3mol,铝与氢氧化钠产生0.6mol,所以共产生0.9mol,由此分析解答.
解答 解:第一份钠先与硫酸,钠的物质的量为:$\frac{13.8g}{23g/mol}$=0.6mol,生成氢气都是0.3mol,消耗硫酸0.2mol,同时生成0.2mol的氢氧化钠,10.8gAl物质的量为0.4mol,与铝反应生成0.3mol的氢气,所以第一份共产生氢气的物质的量为:0.3mol+0.3mol=0.6mol;而第二份10.8gAl物质的量为0.4mol,完全反应所需氢氧化钠的物质的量为:0.4mol,而氢氧化钠的总物质的量为:0.6+0.2=0.8mol,所以氢氧化钠过量,则钠与水产生氢气的量为:0.3mol,铝与氢氧化钠产生0.6mol,所以共产生0.9mol,两溶液中产生的H2在标准状况下的体积比为0.6:0.9=2:3,故选C.
点评 本题考查了根据化学方程式的计算,完成此题,可以依据题干提供的信息结合得失电子守恒定律进行.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
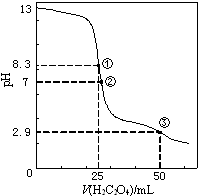 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )
25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-) | |
| B. | 点②所示溶液中:c(HC2O4-)+2c(C2O42-)=c(Na+)+c(H+) | |
| C. | 点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| D. | 滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸钠水解的平衡常数Kh随温度升高而减小 | |
| B. | 0.5mol•L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol•L-1醋酸钠溶液pH为n,水解的程度为b,则m<n、a>b | |
| C. | 醋酸钠的水解的平衡常数Kh=KW•Ka | |
| D. | 在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol•L-1,向其中加入固体醋酸钠,使其浓度为0.9mol•L-1,以上三种金属离子中只有Zn2+能生成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲和乙互为同分异构体,均既能发生氧化反应,又能发生酯化反应 | |
| B. | 分子中共平面的碳原子数相同 | |
| C. | 可用红外光谱区分,但不能用核磁共振氢谱区分 | |
| D. | 均能与溴水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.
CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.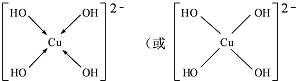 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
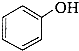
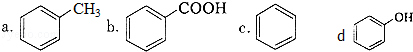
 )是一种重要的有机化工原料.
)是一种重要的有机化工原料.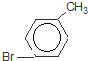 或
或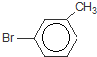 或
或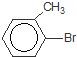 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ②③④⑥ | C. | ③④⑤⑥ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH3 | B. | CH2=CH-CH3 | C. | CH2=CH-CH2-CH3 | D. | CH2=C(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 4种 | C. | 9种 | D. | 13种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com