
【题目】铝与NO3-在酸性或碱性条件下均可反应,回答下列问题:
(1)为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,完善并配平该反应:__Al +___NO3- + ___OH- = ____________+ ____N2↑ + ____H2O。每消耗1mol NO3-,转移的电子数目为_____。
(2)某同学取一定质量的铁铝合金与100mLxmol/L稀硝酸充分反应,反应过程中没有气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)的关系如图所示。

①写出EF段发生反应的离子方程式_________________________________________。
② C点对应的溶液中含有的阳离子除Na+外,还含有___________________________。
③ x=_________。
④铁铝合金中铝的物质的量分数为______________________。
【答案】 10 6 4 10AlO2- 3 2 5NA Al(OH)3+OH=AlO2+2H2O NH4+、Al3+、Fe3+ 1.48 25%
【解析】
(1)为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,完善并配平该反应:根据电子守恒:Al-Al3+失去3个电子,NO3-- N2得10个电子,最小公倍数30,得到方程式为:
10Al +6 NO3-+ 4OH-= 10AlO2- + 3N2↑ + 2H2O。
每消耗1mol NO3-,转移的电子数目为30![]() =5mol
=5mol
(2) 由图像可以看出金属和酸反应是酸过量,线段OC段,CD段产生沉淀Al(OH)3,Fe(OH)3
DE段 EF段沉淀Al(OH)3溶于过量的减,离子反应方程式:Al(OH)3 + OH- = AlO2- + 2H2O
② C点对应的溶液中含有的阳离子除Na+外,还含有Al3+ 、Fe3+ NH4+ 。
③ 根据图可知:OC段为H++OH-=H2O CD段 Al+3OH-=Al(OH)3![]() ;Fe+3OH-= Fe(OH)3
;Fe+3OH-= Fe(OH)3![]() ;DE段NH4++OH-=NH3.H2O 又因 8Fe+30HNO3= 8Fe(NO3)3+3NH4NO3+9H2O 8Al+30HNO3= 8Al(NO3)3+3NH4NO3+9H2O消耗硝酸的物质的量,n(OH)=0.034L
;DE段NH4++OH-=NH3.H2O 又因 8Fe+30HNO3= 8Fe(NO3)3+3NH4NO3+9H2O 8Al+30HNO3= 8Al(NO3)3+3NH4NO3+9H2O消耗硝酸的物质的量,n(OH)=0.034L![]() 4mol/L+0.003
4mol/L+0.003![]() =0.148mol,所以X=
=0.148mol,所以X=![]() =1.48mol/L.本题答案:1.48
=1.48mol/L.本题答案:1.48
④根据图示及③中的反应知铁铝合金中铝的物质的量分数为:25![]()


科目:高中化学 来源: 题型:
【题目】化学反应原理在化工生产和实验中有着广泛而重要的应用。
Ⅰ.利用含锰废水(主要含Mn2+、SO![]() 、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工艺流程如下:
、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工艺流程如下:

已知某些物质完全沉淀的pH如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CuS | MnS | MnCO3 |
沉淀完全时的pH | 3.2 | 5.4 | 6.4 | 9.8 | ≥0 | ≥7 | ≥7 |
回答下列问题:
(1)过程②中,所得滤渣W的主要成分是______________________。
(2)过程③中,发生反应的离子方程式是______________________。
(3)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3的反应的离子方程式是_______________________。
(4)由MnCO3可制得重要的催化剂MnO2:2MnCO3+O2===2MnO2+2CO2。现在空气中加热460.0 g MnCO3,得到332.0 g产品,若产品中杂质只有MnO,则该产品中MnO2的质量分数是________(用百分数表示,小数点后保留1位小数)。
Ⅱ.常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN/span> | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)上述盐溶液中的阴离子,结合H+能力最强的是_______________________。
(2)根据表中数据判断,浓度均为0.01 mol·L-1的下列物质的溶液中,酸性最强的是________(填序号)。
A. HCN B. HClO C. C6H5OH D. CH3COOH E. H2CO3
Ⅲ.已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH = Q kJ·mol-1其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH = Q kJ·mol-1其平衡常数随温度变化如下表所示:
温度/℃ | 400 | 500 | 850 |
平衡常数 | 9.94 | 9 | 1 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为___,该反应的Q____(填“>”或“<”)0。
(2)850 ℃时,向体积为10 L的反应器中通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)的浓度变化如图所示,则0~4 min时平均反应速率v(CO)=____。
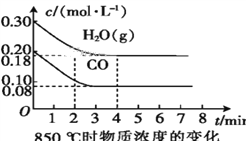
(3)若在500 ℃时进行上述反应,且CO、H2O(g)的起始浓度均为0.020 mol·L-1,该条件下,CO的最大转化率为____。
(4)若在850 ℃时进行上述反应,设起始时CO和H2O(g)共为1 mol,其中水蒸气的体积分数为x,平衡时CO的转化率为y,试推导y随x变化的关系式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成聚丙烯腈纤维的单体是丙烯腈,它可由以下两种方法制备:
方法一:CaCO3﹣→CaO ![]() CaC2
CaC2 ![]() CH≡CH
CH≡CH ![]() CH2═CH﹣CN
CH2═CH﹣CN
方法二:CH2═CH﹣CH3+NH3+ ![]() O2
O2 ![]() CH2═CH﹣CN+3H2O
CH2═CH﹣CN+3H2O
对以上两种途径的分析中,正确的是( )
①方法二比方法一反应步骤少,能源消耗低,成本低
②方法二比方法一原料丰富,工艺简单
③方法二比方法一降低了有毒气体的使用量,减少了污染
④方法二需要的反应温度高,耗能大.
A.①②③
B.①③④
C.②③④
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
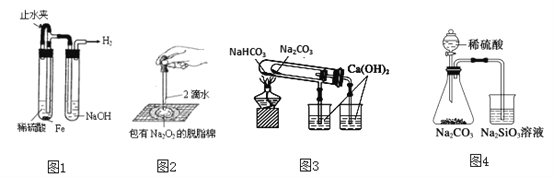
A. 图1:制备并观察氢氧化亚铁
B. 图2:证明过氧化钠与水反应放热
C. 图3:验证NaHCO3和Na2CO3的热稳定性
D. 图4:验证酸性强弱H2SO4>H2CO3>H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )
A. 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA
B. 某密闭容器盛0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA
C. 1 mol Na与足量O2在一定条件下完全反应时转移电子数为NA
D. 1 mol·L-1Na2SO4溶液中,Na+和SO![]() 离子数的总和一定为3NA
离子数的总和一定为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中微粒能大量共存,且当加入试剂后反应的离子方程式书写正确的是( )
选项 | 微粒组 | 加入试剂 | 发生反应的离子方程式 |
A | Fe3+、I-、Cl- | NaOH溶液 | Fe3++3OH-===Fe(OH)3↓ |
B | K+、NH3·H2O、CO | 通入少量CO2 | 2OH-+CO2===CO |
C | H+、Fe2+、SO | Ba(NO3)2溶液 | SO |
D | Na+、Al3+、Cl- | 少量澄清石灰水 | Al3++3OH-===Al(OH)3↓ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol·L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是 ( )
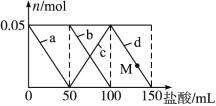
A. a曲线表示的离子方程式为:AlO2-+H++H2O ==Al(OH)3↓
B. b和c曲线表示的离子反应是相同的
C. M点时,溶液中沉淀的质量为3.9 g
D. 原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物的核磁共振氢谱中出现三组峰的是( )
A.2,2,3,3﹣四甲基丁烷
B.2,3,4﹣三甲基戊烷
C.3,4﹣二甲基己烷
D.2,5﹣二甲基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物的顺序排列的是
A. 胆矾、液态氧、黑火药 B. 生石灰、白磷、熟石灰
C. 干冰、铁、氯化氢 D. 烧碱、氮气、冰水混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com