
 短周期主族元素A,B,C,D,E,F的原子序数依次增大,它们的原子核外电子层数之和为13.B的化合物种类繁多,数目庞大;C,D是空气中含量最多的两种元素,D,E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素.试回答以下问题:
短周期主族元素A,B,C,D,E,F的原子序数依次增大,它们的原子核外电子层数之和为13.B的化合物种类繁多,数目庞大;C,D是空气中含量最多的两种元素,D,E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素.试回答以下问题: ,A、C、F三种元素形成的化合物CA4F为离子化合物(填“离子”或“共价”).
,A、C、F三种元素形成的化合物CA4F为离子化合物(填“离子”或“共价”).分析 短周期主族元素A、B、C、D、E、F 的原子序数依次增大,B形成的化合物种类繁多,则B为C元素;C、D为空气中含量最多的两种元素,D的原子序数较大,则C为N元素,D为O元素;D、E形成两种不同的离子化合物,则E为Na;F为同周期半径最小的元素,F处于第三周期期,所以F为Cl元素;它们的原子核外电子层数之和为13,则A最外层电子数为13-3-3-2-2-2=1,则A为H元素,据此解答.
解答 解:短周期主族元素A、B、C、D、E、F 的原子序数依次增大,B形成的化合物种类繁多,则B为C元素;C、D为空气中含量最多的两种元素,D的原子序数较大,则C为N元素,D为O元素;D、E形成两种不同的离子化合物,则E为Na;F为同周期半径最小的元素,F处于第三周期期,所以F为Cl元素;它们的原子核外电子层数之和为13,则A最外层电子数为13-3-3-2-2-2=1,则A为H元素.
(一)(1)化学组成为COCl2的电子式为: ,A、C、F三种元素形成的化合物NH4Cl为 离子化合物,
,A、C、F三种元素形成的化合物NH4Cl为 离子化合物,
故答案为: ;离子;
;离子;
(2)化合物甲、乙由H、C、O、Na中的三种或四种组成,且甲、乙的水溶液均呈碱性,二者可以反应,则为氢氧化钠与碳酸氢钠,故反应的离子方程式为:OH-+HCO3-=CO32-+H2O,
故答案为:OH-+HCO3-=CO32-+H2O;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故C、D、E、F形成的简单离子的离子半径由大到小的顺序是:Cl->N3->O2->Na+,
故答案为:Cl->N3->O2->Na+;
(4)碳元素非金属性比Cl元素非金属性弱,利用强酸制备弱酸原理可以证明,反应化学方程式为:Na2CO3+2HClO4=CO2↑+H2O+2NaClO4 或 NaHCO3+2HClO4=CO2↑+H2O+NaClO4,
故答案为:弱;Na2CO3+2HClO4=CO2↑+H2O+2NaClO4 或 NaHCO3+2HClO4=CO2↑+H2O+NaClO4;
(二)(1)电池反应为:4NH3+3O2=2N2+6H2O,原电池负极反应氧化反应,氨气在负极失去电子,该电池负极的电极反应式为:2NH3+6OH--6e-=N2+6H2O,3.4g NH3的物质的量为$\frac{3.4g}{17g/mol}$=0.2mol,转移电子数目为0.6NA,
故答案为:2NH3+6OH--6e-=N2+6H2O;0.6NA;
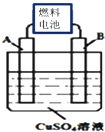
(2)用NH3燃料电池电解CuSO4溶液,A、B均为铂电极,通电一段时间后,在A电极上有红色固体析出,即析出Cu,A为阴极,B为阳极,则B电极上氢氧根离子生成氧气,B电极的电极反应式为:4OH--4e-=O2↑+2H2O,电解池总反应式为:CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$Cu+O2↑+H2SO4,此时向所得溶液中加入8gCuO固体后恰好可使溶液恢复到电解前的浓度,则生成的氧气为$\frac{8g}{80g/mol}$×$\frac{1}{2}$=0.05mol,标况下氧气体积为0.05mol×22.4L/mol=1.12L,
故答案为:4OH--4e-=O2↑+2H2O;1.12.
点评 本题以元素推断为载体,考查电子式、元素化合物性质、元素周期律、微粒半径比较、原电池与电解原理等,是对学生综合能力的考查,推断元素是解题关键,注意理解掌握金属性、非金属性强弱比较实验事实,较好氧化还原反应理解电化学原理.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 22.4L氯气用氢氧化钠溶液充分吸收,反应中转移了0.5NA个电子 | |
| B. | 标准状况下分子总数为0.5 NA的H2O与CO2的总体积为11.2 L | |
| C. | 0.1 mol•L-1的NaCl溶液中含有0.1NA个Na+ | |
| D. | 2.3g钠与足量的水反应产生氢气的分子数为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,44 g CO2气体中含有的碳原子数为nA | |
| B. | 常温常压下,11.2 L 氯化氢气体中含有的分子数为0.5nA | |
| C. | 1 mol铁与足量的稀硫酸完全反应转移的电子数为3nA | |
| D. | 1 L 1 mol•L-1 CuCl2溶液中含有的氯离子数为nA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
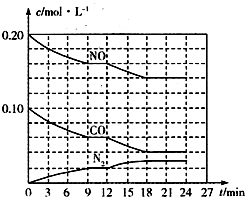 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇的结构简式:C2H6O | |
| B. | 硫离子的结构示意图: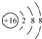 | |
| C. | 氮气的电子式: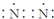 | |
| D. | 氢氧化钡的电离方程式:Ba(OH)2═Ba2++(OH-)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
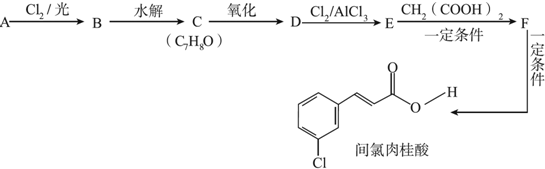
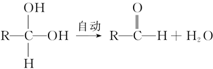
 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$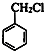 +HCl.
+HCl.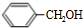 +CH3COOH$→_{△}^{浓硫酸}$
+CH3COOH$→_{△}^{浓硫酸}$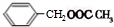 +H2O.
+H2O.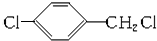 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾是常用的水处理剂,可以用来淡化海水 | |
| B. | 患有胃溃疡的病人的胃酸过多,可以用小苏打医治 | |
| C. | 生活中常用的铝制品与不锈钢制品不易腐蚀,其原理不同 | |
| D. | 食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用完全相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com