
【题目】在一定温度下,某浓度的硝酸与金属锌反应,生成NO2和NO的物质的量之比为1︰3。则要使1mol金属锌完全反应,需要HNO3的物质的量为
A. 0.8 B. 2.4 C. 2.6 D. 2.8
科目:高中化学 来源: 题型:
【题目】某同学在做浓硫酸与铜反应的实验过程中,观察到铜片表面变黑,于是对黑色物质的组成进行实验探究。
(1)用如右图所示装置进行实验1。(加热和夹持仪器已略去)

实验1:铜片与浓硫酸反应
操作 | 现象 |
加热到120℃~250℃ | 铜片表面变黑,有大量气体产生,形成墨绿色浊液 |
继续加热至338℃ | 铜片上黑色消失,瓶中出现“白雾”,溶液略带蓝色,瓶底部有较多灰白色沉淀 |
①装置B的作用是________;装置C中盛放的试剂是_______。
②为证明A装置中灰白色沉淀的主要成分为硫酸铜,实验操作及现象是___________。
(2)探究实验1中120℃~250℃时所得黑色固体的成分。
【提出猜想】黑色固体中可能含有CuO、CuS、Cu2S中的一种或几种。
【查阅资料】
资料1:亚铁氰化钾[K4Fe(CN)6]是Cu2+的灵敏检测剂,向含有Cu2+的溶液中滴加亚铁氰化钾溶液,生成红棕色沉淀。
资料2:
CuS | Cu2S |
黑色结晶或粉末 | 灰黑色结晶或粉末 |
难溶于稀硫酸;可溶于硝酸;微溶于浓氨水或热的浓盐酸 | 难溶于稀硫酸和浓盐酸;可溶于硝酸;微溶于浓氨水 |
【设计并实施实验】
实验2.探究黑色固体中是否含CuO
操作 | 现象 |
i.取表面附着黑色固体的铜片5片,用清水洗干净,放入盛有10mL试剂A的小烧杯中,搅拌 | 黑色表层脱落,露出光亮的铜片 |
ii.取出铜片,待黑色沉淀沉降 | 上层溶液澄清、无色 |
①试剂A是_________。
②甲认为ii中溶液无色有可能是Cu2+浓度太小,于是补充实验确认了溶液中不含Cu2+,补充的实验操作及现象是______。
实验3.探究黑色固体中是否含CuS、Cu2S
操作 | 现象 |
i.取实验2中黑色固体少许,加入适量浓氨水,振荡后静置 | 有固体剩余,固液分界线附近的溶液呈浅蓝色 |
ii.另取实验2中黑色固体少许,加入适量浓盐酸,微热后静置 | 有固体剩余,溶液变成浅绿色 |
【获得结论】由实验2和实验3可得到的结论是:实验1中,120℃~250℃时所得黑色固体中_______。
【实验反思】
分析实验1中338℃时产生现象的原因,同学们认为是较低温度时产生的黑色固体与热的浓硫酸进一步反应造成。已知反应的含硫产物除无水硫酸铜外还有二氧化硫,则黑色固体消失时可能发生的所有反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释物质用途或现象的反应方程式不准确的是
A. 硫酸型酸雨的形成会涉及反应2H2SO3+O2![]() 2H2SO4
2H2SO4
B. 工业上制取粗硅的化学方程式:SiO2+C![]() Si+CO2↑
Si+CO2↑
C. Na2S2O3溶液中加入稀硫酸:S2O32-+2H+=SO2+S↓+H2O
D. 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+=Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2和O2反应生成2molSO3时,放出的热量为QkJ,在1L的密闭容器中进行反应2SO2(g)+O2(g)![]() 2SO3(g),SO2、O2、SO3的起始物质的量分别为0.2mol、0.1mol、0.2mol,下列叙述正确的是( )
2SO3(g),SO2、O2、SO3的起始物质的量分别为0.2mol、0.1mol、0.2mol,下列叙述正确的是( )
A. 某时刻,SO3的物质的量为0.28 mol,则SO2的转化率为40%
B. 反应达到平衡时放出的热量为0.1QkJ
C. 某时刻,SO2、O2、SO3的物质的量分别为0.3mol、0.15mol、0.15mol
D. 某时刻,SO3的浓度可能为0.4mol-1·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是
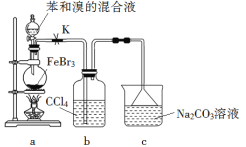
A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。一旦泄露需要及时处理,一般可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染。
I.已知:氰化钠化学式为NaCN,氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)写出NaCN的电子式____________,CN-中C元素显+2价,N元素显-3价,则非金属性N_______C(填“<”“>”或“==”)(1分),请设计实验证明:__________________________。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是_______________________________________________________。
Ⅱ.硫代硫酸钠的工业制备的反应原理为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学兴趣小组用上述原理实验室制备硫代硫酸钠,并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
(查阅资料)ⅰ.Na2S2O3易溶于水,其稀溶液与BaCl2溶液混合物无沉淀生成。
ⅱ.Na2S2O3易被氧化;BaSO3难溶于水,可溶于稀盐酸。实验室通过如下图所示装置制备Na2S2O3。
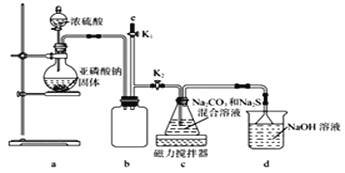
(1)实验中要控制SO2生成速率,可采取的措施有____________________ (写出一条)。
(2)b装置的作用是____________________________。
(3)反应开始后,c中先有淡黄色浑浊产生后又变为澄清,此浑浊物______(填化学式)。
(4)实验结束后,在e处最好连接盛______ (填“NaOH溶液”、“水”、“CCl4”中的一种) 的注射器,接下来的操作为______,最后拆除装置。
(5)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,____________________________。若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用含磷洗涤剂(含有Na5P3O10)会引起水域含磷量升高,造成环境污染,Na5P3O10中磷元素的化合价是( )
A. —3 B. +2 C. +3 D. +5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法正确的是
A. 标准状况下,22.4L苯中含有的碳氢键数目为6NA
B. 标准状况下,22.4LNO与11.2L 的O2组成的混合气体中含有的原子数为3NA
C. 25℃时,pH=1的CH3COOH溶液中含有的H+数目等于0.1NA
D. 已知反应: Cu2S+O2![]() 2Cu+SO2,每生成1molCu转移的电子数为2NA
2Cu+SO2,每生成1molCu转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、SO42-、HCO3-、CO32-等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示,下列说法错误的是

A.海水pH约为8的原因主要是天然海水含CO32-、HCO3-
B.吸收塔中发生的反应有SO2+H2O![]() H2SO3
H2SO3
C.氧化主要是氧气将HSO3-、SO32-、H2SO3氧化为SO42-
D.经稀释“排放”出的废水中,SO42-浓度与海水相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com