
“酸化”是实验中经常采用的方法,下列酸化过程正确的是( )
|
| A. | 抑制Fe2+的水解,用稀硝酸酸化 |
|
| B. | 提高高锰酸钾的氧化能力,用盐酸酸化 |
|
| C. | 确认溶液中含有SO42﹣时,用盐酸酸化,再检验 |
|
| D. | 检验氯乙烷中的氯元素,加碱溶液加热后,用稀硫酸酸化,再检验 |
| 硫酸根离子的检验;硝酸的化学性质;物质的检验和鉴别的实验方案设计.. | |
| 专题: | 物质检验鉴别题. |
| 分析: | A.从硝酸有强氧化性的角度分析; B.高锰酸钾在酸性条件下与氯离子发生氧化还原反应; C.检验溶液中是否含有SO42﹣时,要防止SO32﹣、CO32﹣等离子对SO42﹣的干扰; D.检验氯乙烷中的氯元素时,应在碱性条件后加酸中和,再加入硝酸银溶液观察是否有白色沉淀生成. |
| 解答: | 解:A.硝酸有强氧化性,能将Fe2+氧化为Fe3+,故A错误; B.由于高锰酸钾具有强氧化性,可先将氯离子氧化为氯气,不能用盐酸酸化,故B错误; C.检验溶液中是否含有SO42﹣时,先加盐酸酸化的目的是为了防止SO32﹣、CO32﹣等离子对SO42﹣的干扰,故C正确; D.检验氯乙烷中的氯元素时,将氯乙烷和NaOH溶液混合加热后,用硝酸酸化,然后加入硝酸银溶液观察是否有白色沉淀生成,硫酸银是白色沉淀,不能用硫酸酸化,故D错误. 故选C. |
| 点评: | 本题考查离子的检验、盐类水解等问题,题目难度中等,检验离子时注意要排除其他离子的干扰. |


科目:高中化学 来源: 题型:
通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是____________;
(2)X与金属钠反应放出氢气,反应的化学方程式是__________________________(有机物用结构简式表示);
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA
B.78 g苯含有C===C键的数目为3 NA
C.常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA
D.标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
核内中子数为N的R2+的质量数为A,则n克它的氧化物所含质子 的物质的量是( )
的物质的量是( )
A.〔n(A-N+8) /(A+16)〕mol
/(A+16)〕mol
B.〔n(A-N+16)/(A+16)〕mol
C.〔n(A-N+8)/ A〕mol
D.〔n(A-N+16)/ A 〕mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某中学探究性学习小组用如图所示的装置进行实验,在室温和标准大气压强下,测得a g含Al 96%的样品甲(样品甲中的杂质不与稀硫酸反应)与稀硫酸完全反应产生的气体体积为b L。现欲在相同条件下 ,用NaOH溶液代替该装置中的稀硫酸来测定某一样品乙中Al的质量分数(样品乙中的杂质不与NaOH溶液反应)。请回答下列问题:
,用NaOH溶液代替该装置中的稀硫酸来测定某一样品乙中Al的质量分数(样品乙中的杂质不与NaOH溶液反应)。请回答下列问题:
(1)Al与NaOH溶液反应的化学方程式为:
.
(2)根据装置图,连接好装置,检查装置的气密性,加入药品后使反应开始发生的操作是
 .
.
(3)本实验中测量气体体积 时应注意的事项有
时应注意的事项有
.
(4)该条件下生成的气体的摩尔体积 (填“大于”、“小于”或“等于”)22.4 L/mol.
(5 )如果铝样品乙的质量为c g,测得气体的体积为d L,则铝样品乙中Al的质量分数计算式 w(Al)= .
)如果铝样品乙的质量为c g,测得气体的体积为d L,则铝样品乙中Al的质量分数计算式 w(Al)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验不是由浊液变清液(溶液)再变浊液的是( )
|
| A. | 大量苯酚和水 |
|
| B. | 大量苯酚和水 |
|
| C. | 硝酸银溶液 |
|
| D. | 碳酸钙和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组模拟工业处理电镀含氰废水并测定处理的效率,利用如图所示装置进行实验.将CN﹣的浓度为0.2mol•L﹣1的含氰废水100mL与100mL NaClO溶液(过量)置于装置②三颈烧瓶中,充分反应.打开分液漏斗活塞,滴入100mL稀H2SO4,关闭活塞.
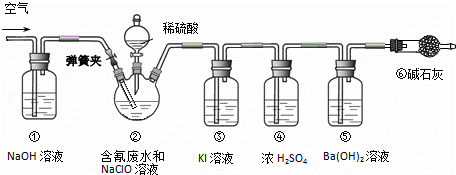
已知装置②中发生的主要反应依次为:
CN﹣+ClO﹣═CNO﹣+Cl﹣;2CNO﹣+2H++3C1O﹣═N2↑+2CO2↑+3C1﹣+H2O
(1)①和⑥的作用是 .
(2)装置②中,生成需由装置③除去的物质的离子方程式为 .
(3)反应结束后,缓缓通入空气的目的是 .
(4)为计算该实验中含氰废水被处理的百分率,需要测定 的质量.
(5)已知CN﹣的处理效率可高达90%,产生的CO2在标准状况下的体积为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
① 醋酸在水溶液中的电离方程式为 。
② 下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是 (填字母序号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
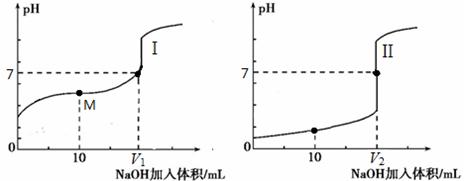
② 滴定醋酸的曲线是 (填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是 。
③ V1和V2的关系:V1 V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
| 操作步骤 | 现象 |
| 步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 | 出现白色沉淀。 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2 mol·L-1 Fe(NO3)3溶液。 | 溶液变红色。 |
| 步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液。 | 现象a ,溶液红色变浅。 |
| 步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液。 | 出现黄色沉淀。 |
① 写出步骤2中溶液变红色的离子方程式 。
② 步骤3中现象a是 。
③ 用化学平衡原理解释步骤4的实验现象 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中微粒浓度关系一定正确的是( )
A.常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+ )
B.常温下,pH=2的一元酸和pH=12的一元强碱等体积混合: c(OH-)=c(H+)
C.0.1 mol·L—1的硫酸铵溶液中:c(NH4+ )>c(SO42 -)>c(H+)
D.0.1 mol·L—1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com