
| A. | 蛋白质溶液 | B. | 牛奶 | C. | 盐酸 | D. | 雾 |
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷和丙烯 | B. | 甲烷和丁烯 | C. | 乙烷和乙烯 | D. | 丙烷和乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
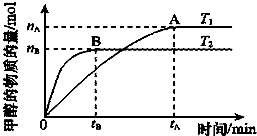 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2 min的平均速率v(Z)=2.0×10-3mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正) | |
| C. | 保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 mol气体Y,到达平衡时,n(Z)=0.24 mol | |
| D. | 其他条件不变,向平衡体系中再充入0.16 mol气体X,与原平衡相比,达到新平衡时,气体Y的转化率增大,X的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )| A. | 有O2参加反应的a极为电池的负极 | |
| B. | 电路中每转移2mole-,则消耗H2的体积为22.4L. | |
| C. | a极对应的电极反应式为O2+2H2O+4e-═4OH- | |
| D. | 该电池的总反应式为2H2+O2$\frac{\underline{\;高温\;}}{\;}$2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaN3是还原剂 | |
| B. | 氧化产物与还原产物物质的量之比为1:15 | |
| C. | N2既是氧化产物又是还原产物 | |
| D. | 标准状况下,当有10mol电子转移时生成358.4L N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,F中的含氧官能团名称酚羟基、羧基;
,F中的含氧官能团名称酚羟基、羧基; ;
; +O2$\stackrel{Cu}{→}$2
+O2$\stackrel{Cu}{→}$2 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E、F、G七种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为生活中的常见金属元素.A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.714g•L-1,C元素原子的最外层电子数是其电子层数的3倍,G长期暴露在空气中表面变绿.E与C同主族.均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.
有A、B、C、D、E、F、G七种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为生活中的常见金属元素.A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.714g•L-1,C元素原子的最外层电子数是其电子层数的3倍,G长期暴露在空气中表面变绿.E与C同主族.均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com