
【题目】
锂离子电池的广泛应用使得锂电池的回收利用一直是科学家关注的焦点。磷酸铁锂是锂电池中最有前景的正极材料,磷酸铁是其前驱体,充放电时可以实现相互转化。某研究性小组对废旧锂离子电池正极材料(图中简称废料,成份为LiFePO4、碳粉和铝箔)进行金属资源回收研究,设计实验流程如下:

已知:① FePO4可溶于稀H2SO4,不溶于水和其他的酸。
② Li2SO4、LiOH和Li2CO3在273K下的溶解度分别为34.2g、22.7g和1.54g,
在373K下,Li2CO3的溶解度为0.72g
③ Ksp[Al(OH)3]=10-32 Ksp[Fe(OH)3]=4×10-38
(1)操作1为: 。
(2)滤液A中通入过量CO2的化学方程式为: 。
(3)可以提高操作1浸出率的方法有(写出3种) 。
(4)完成操作3中的离子方程式: 。
(5)该锂电池充电时的阳极反应式: 。
(6)操作4中应选择试剂: 。
(7)沉淀C的成分: 。
【答案】(1)过滤(2)CO2+2H2O+NaAlO2=NaHCO3+Al(OH)3
(3)升温,搅拌,增大浓度,增加时间等;
(4)2LiFePO4+H2O2+2H+=2Fe3++2Li++2PO43-+2H2O
(5)LiFePO4-e- =FePO4 + Li+(6)NaOH (7)Li2CO3
【解析】试题分析:(1)操作1后得到滤渣,说明是过滤;
(2)铝能与氢氧化钠溶液反应生成偏铝酸钠,通入二氧化碳生成氢氧化铝沉淀,反应的方程式为CO2 + 2H2O + NaAlO2 = NaHCO3 + Al(OH)3。
(3)提高操作1浸出率的方法有升温,搅拌,增大浓度,增加时间等;
(4)正极废料中LiFePO4、碳粉和铝箔在加入氢氧化钠溶液时,铝被溶解,滤渣A中含有LiFePO4、碳粉,在操作3中LiFePO4被双氧水氧化,反应的离子方程式为2LiFePO4+H2O2+2H+=2Fe3++2Li++2PO43-+2H2O。
(5)该锂电池充电时的阳极发生氧化反应,电极反应式为LiFePO4-e- =FePO4 + Li+。
(6)滤液B中含有硫酸铁,操作4是将铁离子沉淀的过程,可以选择试剂氢氧化钠。
(7)根据流程图和信息②,沉淀C为Li2CO3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在①乙醇与氧气在铜催化下反应;②淀粉在稀硫酸作用下在水中加热;③葡萄糖与钠反应;④乙醇一定条件下与乙酸反应中,不包括的反应类型是
A.氧化反应 B.加成反应 C.酯化反应 D.水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3 物质结构与性质】
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)Z2+基态核外电子排布式为: 。
(2)YX4-的空间构型是:__________;与YX4-互为等电子体的一种分子为__________(填化学式);HYX4酸性比HYX2强,其原因是:__________________________。
(3)结构简式为RX(WH2)2的化合物中R原子的杂化轨道类型为: ;1molRX(WH2)2分子中含有σ键数目为:_______________。(H为氢元素,下同)
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是:__________。
A.[Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,WH3提供空轨道
C.[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如右图所示(黑点代表Z原子)。

①该晶体的化学式为: 。
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于 (填“离子”、“共价”)化合物。
③ 已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为: cm(只写计算式)(Z原子位于体对角线上)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池的总反应为:2CH3OH +3O2= 2CO2 ↑+ 4H2O,下图是该电池的示意图。下列说法正确的是
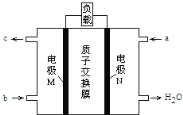
A.a 是氧气,b 是甲醇
B.质子从 N 电极区穿过质子交换膜移向 M 电极区
C.正极反应为:O2 +2H2O + 4e- = 4 OH-
D.当电路中有 3 mole- 转移时,电池中n(H+)变化为 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为主要原料合成一种具有果香味的物质C和化合物D的合成路线如下图所示。

请回答下列问题:
(1)A的结构简式为 ,B分子中的官能团名称为 。
(2)反应⑦中物质X的分子式为 ,反应⑧的类型为 。
(3)反应⑤的化学方程式为 。反应⑥用于实验室制乙烯,为除去其中可能混有的SO2应选用的试剂是 。
(4)已知D的相对分子量为118,其中碳、氢两元素的质量分数分别为40.68%、5.08%,其余为氧元素,则D的分子式为 。
(5)检验反应①进行程度,需要的试剂有_________________。
A.新制的Cu(OH)2悬浊液
B.碘水
C.NaOH溶液
D.FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6。分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198 P—O:360 O===O:498

若生成1 mol P4O6,则反应P4(白磷)+3O2===P4O6中的能量变化为
A.吸收1 638 kJ能量
B.放出126 kJ能量
C.吸收126 kJ能量
D.放出1 638 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答下列问题:
(1)写出元素E在周期表中的位置: ;判断物质X中存在的化学键类型 。
(2)C、D、E分别形成的简单离子半径由大到小的顺序是: (用离子符号表示);C、E氢化物的热稳定性比较 (用具体物质化学式比较)。
(3)B元素的氢化物可以在实验室中制取,

①写出B元素氢化物的电子式 ,其实验室发生装置可以选择上图中的_________,常用的实验室制备反应的化学方程式为___________ ____。
②欲制备并收集一瓶干燥的该气体,选择上图中的装置,其连接顺序为:(按气流方向,用导管口字母表示)____ __。
③欲证明上述盐X溶液中含有的阳离子,其方法是 。
(4)E的最高价态与A、B、C三种元素形成的酸式盐Y在水溶液中的电离方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com