
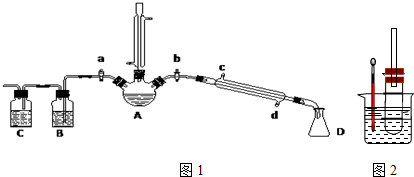
分析 (一)(1)圆底烧瓶中除了加药品外还应加沸石;
(2)加入水可以降低浓硫酸浓度,减少副反应的发生;减少溴的挥发;减少溴化氢的挥发等;
②溴乙烷中也含乙基;
(3)①B装置除去干扰物质溴;C装置检验溴化氢;
②溴乙烷中也含乙基,故此同学的判断错误
(4)根据溴乙烷和溴的性质,逐一分析能够和溴化氢反应且不能和溴乙烷反应试剂,注意除杂不能引进新的杂质;
(二)(1)实验检验溴乙烷再碱性条件下水解反应,反应生成乙醇与NaBr,反应完毕溶液不再分层;溴乙烷与NaOH水溶液反应生成乙醇和溴化钠;
(2)溴乙烷在NaOH乙醇溶液中发生消去反应,生成乙烯,乙烯能够使酸性的高锰酸钾褪色(或者使溴的四氯化碳褪色),只要证明乙烯的存在即可证明发生的是消去反应
解答 解:(一)(1)圆底烧瓶中除了加药品外还应加沸石;
故答案为:沸石;
(2)反应中加入少量的水,防止反应进行时发生大量的泡沫,减少副产物乙醚的生成和避免HBr的挥发,故abc正确,故选abc;
(3)①检验溴化氢,可用硝酸银溶液,但先要除去混有的溴,所以要加入苯,选a,将混合物通过有机溶剂,再通入硝酸银溶液,若有浅黄色沉淀,说明有溴化氢产生,所以选d,
故答案为:a;d;
②由于溴乙烷中也含乙基,故该同学的判断不正确,故答案为:不正确;溴乙烷中也含乙基;
(4)a.KI和溴单质反应,但生成的碘单质会混入,故a错误;
b.溴单质和氢氧化钠反应,溴代烷也和NaOH溶液中水解反应,故b错误;
c.溴乙烷和Br2都能溶于四氯化碳,故c错误;
d.溴单质和Na2SO3溶液发生氧化还原反应,可以除去溴单质,故d正确;故答案为:d;
(二)(1)实验检验溴乙烷再碱性条件下水解反应,反应生成乙醇与NaBr,液体不再分层,表明溴乙烷与NaOH溶液已完全反应,溴乙烷与NaOH水溶液反应生成乙醇和溴化钠,反应方程式为CH3CH2Br+H2O$\stackrel{NaOH}{→}$CH3CH2OH+HBr,
故答案为:液体不分层;CH3CH2Br+H2O$\stackrel{NaOH}{→}$CH3CH2OH+HBr;
(2)溴乙烷在NaOH乙醇溶液中发生消去反应,生成乙烯,只有证明乙烯的存在即可证明发生的是消去反应,即证明生成的气体,方法是:将生成的气体先通过盛有水的试管,再通入盛有酸性KMnO4溶液的试管,酸性KMnO4溶液褪色(或直接通入溴的四氯化碳溶液,四氯化碳褪色),
故答案为:生成的气体;将生成的气体先通过盛有水的试管,再通入盛有酸性KMnO4溶液的试管,酸性KMnO4溶液褪色(或直接通入溴的四氯化碳溶液,四氯化碳褪色).
点评 本题考查了卤代烃的结构和性质,题目难度中等,注意溴乙烷发生取代反应,生成乙醇与氢溴酸;发生消去反应,生成乙烯和氢溴酸,抓住不同条件下生成的不同产物的性质是设计实验的关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
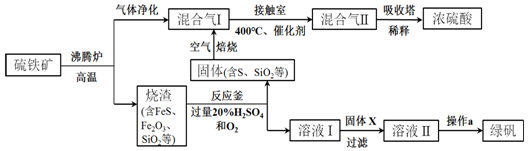
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
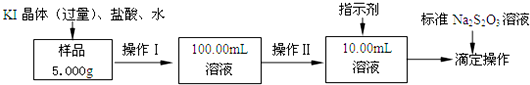
科目:高中化学 来源: 题型:解答题
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| ① | 50.0 | 2.0 | 薄片 | 15 | 200 | m1 |
| ② | 50.0 | 2.0 | 薄片 | 25 | 100 | m2 |
| ③ | 50.0 | 2.0 | 颗粒 | 25 | 70 | m3 |
| ④ | 50.0 | 2.0 | 颗粒 | 35 | 35 | m4 |
| ⑤ | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
| ⑥ | 50.0 | 4.0 | 粉末 | 25 | t2 | m5 |
| ⑦ | 50.0 | 6.0 | 粉末 | 25 | t3 | 14.9 |
| ⑧ | 50.0 | 8.0 | 粉末 | 25 | t4 | 19.3 |
| ⑨ | 50.0 | 10.0 | 粉末 | 25 | t5 | m6 |
| ⑩ | 50.0 | 12.0 | 粉末 | 25 | t6 | 19.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;其2p能级的轨道有3个伸展方向,电子云的形状为纺锤形.
;其2p能级的轨道有3个伸展方向,电子云的形状为纺锤形.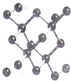
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
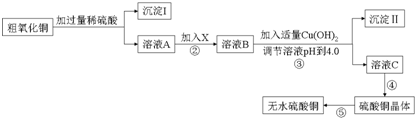
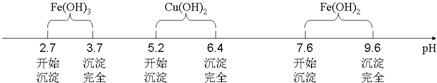
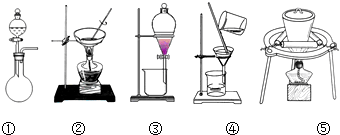
| 滴定次数 | 第一次 | 第二次 | 第三次 |
| 滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
| 滴定滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 ;该反应的类型为取代.
;该反应的类型为取代.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com