
分析 根据发生的反应为Fe+CuSO4═FeSO4+Cu,利用差量法来计算.
解答 解:铁和硫酸铜反应方程式为:
Fe+CuSO4 ═FeSO4 +Cu△m
56g 1 1 1 (64-56)g=8g
n(CuSO4) n(Cu) 2g
$\frac{n(Cu)}{1}$=$\frac{n(CuSO4)}{1}$=$\frac{2g}{8g}$
n(Cu)=0.25mol,n(CuSO4)=0.25mol
m (Cu)=n(Cu)×M(Cu)=0.25mol×64g/mol=16g
C (CuSO4)=$\frac{n(CuSO4)}{V}$=$\frac{0.25mol}{0.5L}$=0.5mol/L
故答案为:(1)反应中生成铜的质量为16g;
(2)反应后溶液的体积仍为500mL,则该溶液中各溶质的物质的量浓度为0.5mol/L.
点评 本题考查学生利用化学反应方程式的计算,明确物质的质量变化及差量法来计算是解答本题的关键,难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
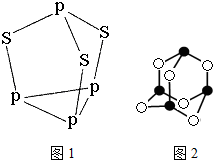 磷和砷元素形成的化合物在生活和生产中有重要的用途,回答下列问题.
磷和砷元素形成的化合物在生活和生产中有重要的用途,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaF 的水解产物是NaOH 和HF | B. | CaO2 的水解产物是Ca(OH)2 和H2O2 | ||
| C. | PCl3 的水解产物之一是PH3 | D. | Mg3N2水解产物是Mg(OH)2和NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应生成NO2的速率和逆反应生成O2的速率相等 | |
| B. | 反应容器中密度不随时间变化而变化 | |
| C. | 混合气体颜色深浅保持不变 | |
| D. | NO2、NO、O2的物质的量浓度之比为2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
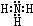 ,B的结构式为
,B的结构式为 .
. .
.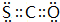 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
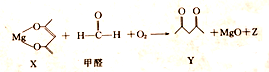
| A. | X 是还原剂 | B. | Y的分子式为C5H8O2 | ||
| C. | Z的摩尔质量为44g | D. | 除去1mol甲醛时,转移2mole- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下使氢成为二次能源 | |
| B. | 寻找优质催化剂,使CO2与H2O反应生成CH4和O2,并放出热量 | |
| C. | 寻找优质催化剂,利用太阳能使大气中的CO2和海底开采的CH4合成合成气(CO、H2) | |
| D. | 将固态碳合成C60,以C60作燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
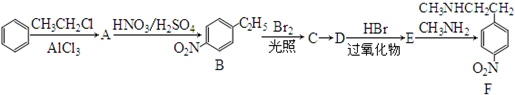
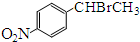 .
.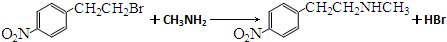 .
.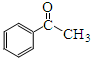 )常用作有机化学合成的中间体,参照上述合成F的部分步骤,设计一条以苯为起始原料制备苯乙酮的合成路线
)常用作有机化学合成的中间体,参照上述合成F的部分步骤,设计一条以苯为起始原料制备苯乙酮的合成路线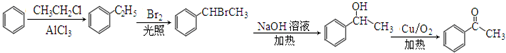 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com