
| A. | Fe在少量Cl2中燃烧生成FeCl2 | |
| B. | 石油的裂解、煤的干馏都是化学变化 | |
| C. | 化学反应的焓变与反应的途径有关 | |
| D. | 等质量的铜按a、b两种途径完全转化为硝酸铜,途径a、b消耗的硝酸一样多 途径a:Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀硝酸}{→}$Cu(NO3)2;途径b:Cu$\stackrel{稀硝酸}{→}$Cu(NO3)2 |
分析 A.Fe与氯气反应生成氯化铁;
B.石油裂解得到甲烷、乙烯等,煤的干馏得到苯等;
C.焓变与反应的途径无关,与起始状态有关;
D.a中硝酸只作酸,b中硝酸作氧化剂和酸.
解答 解:A.Fe在少量Cl2中燃烧生成FeCl3,与量无关,故A错误;
B.石油裂解得到甲烷、乙烯等,煤的干馏得到苯等,均有新物质生成,则均为化学变化,故B正确;
C.焓变与反应的途径无关,与起始状态有关,故C错误;
D.a中硝酸只作酸,b中硝酸作氧化剂和酸,则等量Cu制备硝酸铜时,b消耗的硝酸多,故D错误;
故选B.
点评 本题考查元素化合物的性质,为高频考点,把握物质的性质及发生的反应为解答的关键,侧重分析与应用能力的考查,选项D为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:解答题
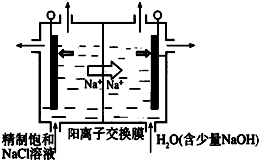 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺查看答案和解析>>
科目:高中化学 来源: 题型:解答题
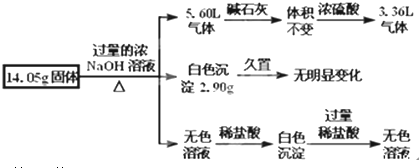
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
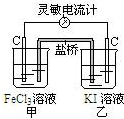
| A. | 反应开始时,乙中石墨电极上发生还原反应 | |
| B. | 反应开始时,甲中石墨电极上Fe3+被氧化 | |
| C. | 盐桥中的K+向乙中迁移,Cl-向甲中迁移 | |
| D. | 电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
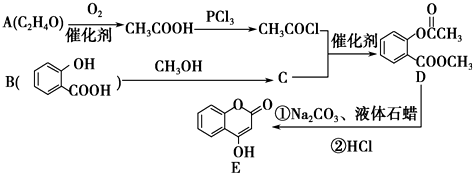
 +2NaOH $\stackrel{△}{→}$
+2NaOH $\stackrel{△}{→}$  +H2O.
+H2O. 是一种重要的有机合成中间体.
是一种重要的有机合成中间体. ;②光照时,甲苯与Cl2侧链取代.
;②光照时,甲苯与Cl2侧链取代.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
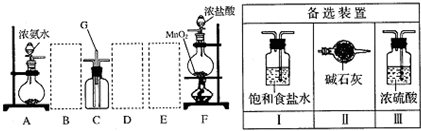
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ③④⑤ | C. | ④⑥⑦ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
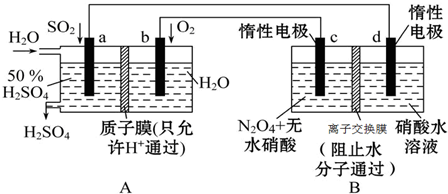
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com