
【题目】欲测定Mg(NO3)2nH2O中结晶水的含量,下列方案中肯定不可行的是
A.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量
B.称量样品→加热→冷却→称量Mg(NO3)2
C.称量样品→加热→冷却→称量MgO
D.称量样品→加NaOH溶液→过滤→加热→冷却→称量MgO
科目:高中化学 来源: 题型:
【题目】元素周期表中第VIIA族元素的单质及其化合物的用途广泛.完成下列填空:
(1)与氯元素同族的短周期元素的原子核外有___种不同能量的电子.
(2)能作为溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是___(填序号).
a.IBr中溴为﹣1价 b.HBr、HI的酸性c.HBr、HI的热稳定性 d.Br2、I2的熔点
(3)海水提溴过程中,先向浓缩海水中通入_____,将其中的Br﹣氧化,再用“空气吹出法”吹出Br2,并用纯碱吸收.已知纯碱吸收溴的主要反应是:Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),则吸收1mol Br2,转移电子_____mol,反应中氧化产物为_____.
(4)已知:AlF3的熔点为1040℃,AlCl3在178℃升华.从物质结构的角度解释两者熔点相差较大的原因:__________
(5)HClO有很好的杀菌消毒效果.为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在某一容积为2L的密闭容器中,某一反应中A、B、C、D四种气体的物质的量n(mol)随时间t(min)的变化曲线如图所示:
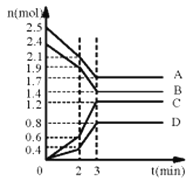
回答下列问题:
①该反应的化学方程式为___。
②前2min用A的浓度变化表示的化学反应速率为__。在2min时,图像发生改变的原因可能是__(填字母)。
a.增大压强 b.降低温度 c.加入催化剂 d.增加A的物质的量
(2)在100℃时,将0.01mol的N2O4气体充入0.1L的密闭容器中发生反应,隔一定时间对该容器内的物质进行分析,得到如下表格:
时间/s 浓度/mol·L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/mol·L-1 | 0.100 | 0.070 | 0.050 | a | b | c |
c(NO2)/mol·L-1 | 0.000 | 0.060 | d | 0.120 | 0.120 | 0.120 |
试填空:
①该反应的化学方程式__,达到平衡时N2O4的转化率为__。
②在0~20s内,四氧化二氮的平均反应速率为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年12月20日,美国总统特朗普签署了2020财政年度国防授权法案,对俄罗斯向欧洲进行天然气输出的“北溪2号”管道项目实施制裁,实施“美国优先发展战略”。天然气既是一种优质能源,又是一种重要化工原料,甲烧水蒸气催化重整制备高纯氢是目前的研究热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,已知在反应器中存在如下反应过程:
Ⅰ.![]()
Ⅱ.![]()
根据上述信息请写出甲烷水蒸气催化重整的热化学反方程式:________________。
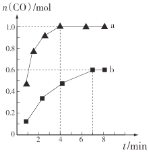
(2)在一定条件下向a、b两个恒温恒容的密闭容器中均通入![]() 和
和![]() ,利用反应Ⅰ制备
,利用反应Ⅰ制备![]() ,测得两容器中CO的物质的量随时间的变化曲线分别为a和b(已知容器a、b的体积为2 L)。
,测得两容器中CO的物质的量随时间的变化曲线分别为a和b(已知容器a、b的体积为2 L)。
则a、b两容器的温度________(填“相同”“不相同”或“不确定”);在达到平衡前,容器a的压强________(填“逐渐增大”“不变”或“逐渐减小”);容器a中![]() 从反应开始到恰好平衡时的平均反应速率为________,在该温度下反应的化学平衡常数K=________。
从反应开始到恰好平衡时的平均反应速率为________,在该温度下反应的化学平衡常数K=________。
(3)某氢氧燃料电池以熔融态的碳酸盐为电解质,其中![]() 参与电极反应。工作时负极的电极反应为
参与电极反应。工作时负极的电极反应为![]() 。如图所示,根据相关信息回答下列问题:
。如图所示,根据相关信息回答下列问题:
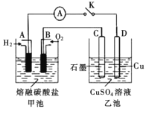
①正极的电极反应为________;
②当甲池中A电极理论上消耗![]() 的体积为448 mL(标准状况)时,乙池中C、D两电极质量变化量之差为________g。
的体积为448 mL(标准状况)时,乙池中C、D两电极质量变化量之差为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸,又称草酸,通常在空气中易被氧化而变质。其两分子结晶水(H2C2O4·2H2O)却能在空气中稳定存在。在分析化学中常用H2C2O4·2H2O做KMnO4的滴定剂,下列关于H2C2O4的说法正确的是
A.草酸是二元弱酸,其电离方程式为H2C2O4![]() 2H++C2O
2H++C2O![]()
B.草酸滴定KMnO4属于中和滴定,可用石蕊做指示剂
C.乙二酸可通过乙烯经过加成、水解、氧化再氧化制得
D.将浓H2SO4滴加到乙二酸上使之脱水分解,分解产物是CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁带能在CO2中燃烧,生成氧化镁和单质碳。
(1)碳元素形成的单质有金刚石、石墨、足球烯等。金刚石的熔点远高于足球烯的原因是__________________________。24g金刚石中含有____个碳碳单键。
(2)氧化镁的电子式为_______,CO2的结构式为________。与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为________________,其中能量最高的电子有______个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色植物的光合作用,是地球表面上最普遍的化学变化,也是将___________能转化为________ 能的最主要途径。植物通过光合作用,将二氧化碳和水转化为葡萄糖(C6H12O6),并放出氧气,请写出该反应的化学方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )

A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)是一种绿色环保的还原剂,其氧化产物为氮气。
(1) 合成联氨的有关反应如下:
NH3(g)+NaClO(aq)=NH2Cl(l)+NaOH(aq) ΔH1=-67.45 kJ·mol-1
NH2Cl(l)+NaOH(aq)+NH3(g)=N2H4(l)+NaCl(aq)+H2O(l) ΔH2=-195.32 kJ·mol-1
反应2NH3(g)+NaClO(aq)=N2H4(l)+NaCl(aq)+H2O(l) ΔH=________kJ·mol-1。
(2) 联氨为二元弱碱,在水中的电离方式与氨相似,写出联氨与过量盐酸反应的离子方程式:________。
(3) 联氨—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。该电池放电时,负极的电极反应式是__________。
(4) 若用此碱性燃料电池作电源,电解AgNO3溶液,电解方程式为_________;若阴极析出5.40g金属银,则联氨—空气燃料电池中至少通入标准状况下空气体积________mL(假设空气中氧气体积分数为20%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com