
【题目】赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿按一定比例混合加热可制得铜2Cu2S+Cu2O ![]() 6Cu+SO2↑.对于该反应,下列说法中正确的是( )
6Cu+SO2↑.对于该反应,下列说法中正确的是( )
A.该反应中的氧化剂是Cu2O
B.氧化产物和还原产物的物质的量之比为1:6
C.Cu既是氧化产物又是还原产物
D.Cu2S在反应中仅做氧化剂
科目:高中化学 来源: 题型:
【题目】工业上,向500℃~600℃的铁屑中通入氯气生产无水氯化铁(已知炽热铁屑与氯化氢生成氯化亚铁).现用如图所示的装置模拟上述过程进行试验.
回答下列问题:
(1)盛装浓盐酸的仪器名称为 , 进行实验时,应先点燃(选填A或C)处酒精灯.
(2)制取无水氯化铁的实验中,A中反应的离子方程式为 , 装置B中加入的试剂是 .
(3)制取的无水氯化铁中混有少量氯化亚铁,其原因是(化学方程式表示).为除去氯气中混有的少量HCl,可以在装置A、B间加入装有的洗气瓶.
(4)工业上常用石灰乳吸收制氯气的尾气制得漂白粉,漂白粉的有效成分是(填化学式).长期露置于空气中的漂白粉,加稀盐酸后产生的气体是(填数字代号).
①O2 ②Cl2 ③CO2 ④HClO.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质与NaOH溶液生反应时,因NaOH的相对量不同可能导致产物不同的是( )
A. Al B. Al2O3 C. AlCl3 D. Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与强酸反应又能与强碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题:

(1)A元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为_____________。
(2)同温同压下,将a L A氢化物的气体和b L D的氢化物气体先后通入一盛水的烧杯中,若所得溶液的pH=7,则a_________b(填“>"或“<”或“=”)。
(3)常温下,相同浓度F、G简单离子的溶液中滴加NaOH溶液,F、G两元素先后沉淀,F(OH)n完全沉淀的pH是4.7,G(OH)n完全沉淀的pH是2.8,则在相同条件下,溶解度较大的是:___(填化学式)。
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有:_______________。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(5)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是______。
(6)用电子式表示B,C形成化合物C2B2的过程_______________。
(7)已知一定量的E单质能在B2(g)中燃烧,其可能的产物及能量关系如下图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式__________________。
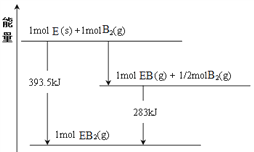
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属晶体的判断正确的是( )
A.简单立方堆积、配位数6、空间利用率68%
B.体心立方堆积、配位数6、空间利用率68%
C.六方最密堆积、配位数8、空间利用率74%
D.面心立方最密堆积、配位数12、空间利用率74%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应Cu(s)+2Ag+(aq)===Cu2+(aq)+2Ag(s)为自发进行的氧化还原反应,将其设计成如右图所示的原电池,下列说法中正确的是( )
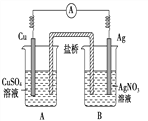
A. 铜电极是正极,其电极反应为Cu-2e-===Cu2+
B. 当铜电极质量减少0.64 g时,电解质溶液中有0.02 mol电子通过
C. 装置盐桥中可装有含琼脂的KCl饱和溶液
D. 银电极上发生还原反应,电极质量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地区使用含较少Ca2+、Mg2+的天然水按下列四个步骤制取自来水。
![]()
回答下列问题:
(1)该地区的天然水属于 (“硬水”或“软水”)
(2)在第一步中需要加入凝聚剂,常用的凝聚剂可以是 (任填一种凝聚剂名称)
(3)常用液氯作为消毒剂,其原理是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com