
(14分)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
CH4(g)+H2O(g) ===CO(g)+3H2(g) ΔH=+206.2 kJ/mol
CH4(g)+CO2(g) ===2CO(g)+2H2(g) ΔH=+247.4 kJ/mol
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
(2)硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。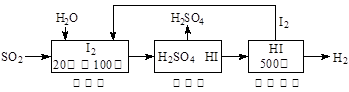
已知1g FeS2完全燃烧放出7.1 kJ热量,FeS2燃烧反应的热化学方程式为 。
该循环工艺过程的总反应方程式为 。
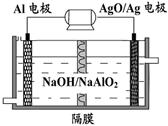
(3)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为 。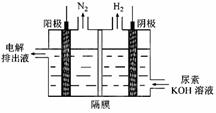
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH Ni(OH)2+M
Ni(OH)2+M
①电池放电时,正极的电极反应式为 。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为 。
(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为 。
(14分)
(1)CH4(g)+2H2O(g) ===CO2(g) +4H2(g) △H=165.0 kJ/mol (2分)
(2)4FeS2(s)+11O2(g) === 2Fe2O3(s)+8SO2(g) △H=-3408 kJ/mol (2分)
2H2O+SO2===H2SO4+H2 (2分)
(3)CO(NH2)2+8OH--6e-===CO32-+N2↑+6H2O (2分)
(4)①NiO(OH)+H2O+e-===Ni(OH)2+OH-(2分)
②2H2O+O2+4e-===4OH- (2分)
(5)2Mg2Cu+3H2 MgCu2+3MgH2 (2分) B
MgCu2+3MgH2 (2分) B
解析试题分析:(1)已知:①CH4(g)+H2O(g)═CO(g)+3H2 (g)△H=-206.2kJ?mol-1②CH4(g)+CO2 (g)═2CO(g)+2H2 (g)△H=-247.4kJ?mol-1由盖斯定律,①×2-②得CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=-165.0 kJ?mol-1,故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=-165.0 kJ?mol-1;
(2)根据题目信息,已知1g FeS2完全燃烧放出7.1 kJ热量,求得4mol FeS2完全燃烧放出3408 kJ热量,故方程式为4FeS2(s)+11O2(g) === 2Fe2O3(s)+8SO2(g) △H=-3408 kJ/mol ;由反应物到最终产物,并根据原子,元素守恒可写为 2H2O+SO2===H2SO4+H2 ;
(3)由图可知,CO(NH2)2在阳极放电生成N2,C元素价态未变化,故还有碳酸钾生成与水生成,电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;
(4)①电池放电时,正极的电极要得到电子,反应式NiO(OH)+H2O+e-===Ni(OH)2+OH-(2分) ②据题意氧气要削耗掉,故反应2H2O+O2+4e-===4OH-
(5)令金属氢化物为RHx,金属R的相对分子质量为a,则X/(a+X)=0.077,即923x=77a,X为金属的化合价,讨论可得x=2,a=24,故该金属氢化物为MgH2,故反应方程式为2Mg2Cu+3H2==MgCu2+3MgH2,故答案为:2Mg2Cu+3H2=MgCu2+3MgH2.
考点:本题考查热化学方程式的书写、电解原理、常用化学用语书写等,(4)(5)为难点、易错点,(4)中根据化合价判断产物,(5)中注意根据讨论进行确定金属氢化物的化学式.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案科目:高中化学 来源: 题型:填空题
I.已知:反应①H2(g) + Cl2(g) = 2HCl(g) ΔH=" —184" kJ/mol
②4HCl(g)+O2(g)  2Cl2(g)+2H2O(g) ΔH=" —115.6" kJ/mol
2Cl2(g)+2H2O(g) ΔH=" —115.6" kJ/mol 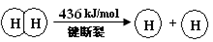
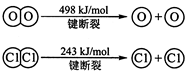
请回答:
(1)H2与O2反应生成气态水的热化学方程式
(2)断开1 mol H—O 键所需能量约为 kJ。
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: 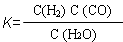 ,它所对应的化学方程式为: 。
,它所对应的化学方程式为: 。
(2)已知在400℃时,N2 (g)+ 3H2(g)  2NH3(g) △H<0 的K="0.5," 则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
2NH3(g) △H<0 的K="0.5," 则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
A.缩小体积增大压强 B.升高温度 C.加催化剂 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:A(g) + 3B(g)  2C(g) + D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
2C(g) + D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
| t/K | 300 | 400 | 500 | … |
| K/(mol·L-1)2 | 4×106 | 8×107 | K1 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
人们已经研制出以丙烷为燃料的新型燃料电池,电解质为熔融碳酸盐,电池总反应方程式为:C3H8+5O2=3CO2+4H2O。
(1)已知:2C3H8(g)+7O2(g)=6CO(g)+8H2O(l)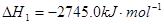
C(s)+O2(g)=CO2(g) 
2C(s)+O2(g)=2CO(g) 
则反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(1)的△H___________________。.
(2)该电池的正极通入O2和CO2,负极通入丙烷,则正极的电极反应式为_________________,电池工作时CO32—移向_____________极。
(3)用该电池电解1L 1 mol·L—1的AgNO3溶液,此电解池反应的化学方程式为______________________;当该电池消耗0.005molC3H8时,所得溶液的pH为__________(溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
2013年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(l)汽车尾气净化的主要原理为: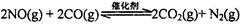 。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断: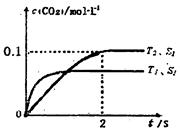
①该反应的ΔH______0(选填“>”、“<”)。
②该反应的平衡常数表达式为____________________
③在T2温度下,0 ~ 2s内的平均反应速率v(N2)_______。
④当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
⑤该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是__________(填代号)。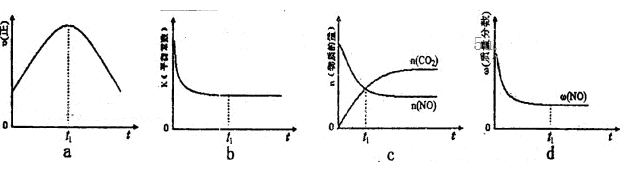
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。例如: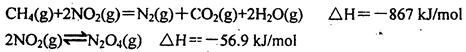
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式______
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
生产甲醇的原料CO、H2可由下列反应制取:CH4(g)+H2O(g) CO(g)+3H2(g),试回答下列问题。
CO(g)+3H2(g),试回答下列问题。
(1)已知:① CH4(g)+3/2 O2(g) CO(g)+2H2O(g)△Hl;
CO(g)+2H2O(g)△Hl;
② H2(g)+1/2 O2(g) H2O(g) △H2,
H2O(g) △H2,
则CH4(g)+ H2O(g) CO(g)+3H2(g)的△H=____ (用含△H1,△H2的式子表示)
CO(g)+3H2(g)的△H=____ (用含△H1,△H2的式子表示)
(2)一定条件下反应CH4(g)+H2O(g) CO(g)+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1, 则上述反应的△H____ 0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA____ KB
CO(g)+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1, 则上述反应的△H____ 0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA____ KB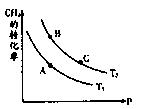
(3)维持温度T2,将0.04 mol CH4和0.04mol H2O(g)通入容积为1L的定容密闭容器中发生反应,平衡时达到B点,测得CH4的转化率为50%,该反应在此温度下的平衡常数KB=____ ,下列现象能说明该反应已经达到平衡状态的是_ ___
a.容器内CH4、H2O、CO、H2的物质的量之比为1:1:1:3
b.容器的密度恒定
c.容器的压强恒定
d.3υ正(CO)=υ逆((H2)
(4)在上述B点平衡基础上,向容器中再通入amol CH4和a mol H2O气体,使之在C点重新达平衡,此时测得CO有0.03mol,则a=____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
目前,消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4 (g)与NO2 (g)反应生成N2 (g) ,CO2(g)和H2O(l)的热化学方程 式_____________________
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下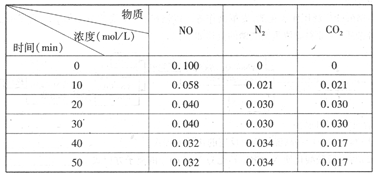
①不能作为判断反应达到化学平衡状态的依据 是_______
A.容器内CO2的浓度保持不变
B.v正(N2)="2" v正(NO)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②在T。C时.该反应的平衡常数为_______(保留两位小数);
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是_______
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:
2CO+2NO N2+2CO2 ΔH<0研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。
N2+2CO2 ΔH<0研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。
①上表中:a=_______,b=________,e=________
②请在给出的坐标图中,画出上表中实验II和实验III条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明相应的实验编号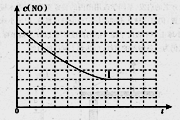
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学反应变化过程及结果的研究。按要求回答问题:
(1)关于反应过程中能量变化的研究:
则:2CO(g)+O2(g)=2CO2(g)△H= kJ·mol-1。
(2)关于反应速率和限度的研究:
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:
2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数(K)和温度(T / ℃)关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数(K)和温度(T / ℃)关系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
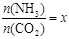 ,下图(1)是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,下图(1)是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。

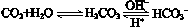 ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:| c(HCO3-)∶c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2(g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
 2CO(g)+2H2(g) 的△H= 。
2CO(g)+2H2(g) 的△H= 。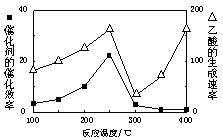
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
SO2、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题。
(1)上述四种气体中直接排入空气时会引起酸雨的有__________(填化学式)。
(2)已知:2SO2(g)+ O2(g)=2SO3(g);△H=-196.6kJ/mol
O2(g)+2NO(g)=2NO2(g);△H=-113.0kJ/mol
①反应:NO2(g) +SO2(g)= SO3(g) +NO(g)的△H=_ kJ/mol。
②一定条件下,将NO2和SO2以体积比1:1置于恒温恒容的密闭容器中发生反应: NO2(g) +SO2(g) SO3(g) +NO(g),
SO3(g) +NO(g),
下列不能说明反应达到平衡状态的是_____(填字母)。
a.体系压强保持不变
b.混合气体的颜色保持不变
c.NO的物质的量保持不变
d.每生成1molSO3的同时消耗1molNO2
(3)CO可用于合成甲醇,其反应的化学方程式为CO(g)+2H2(g)  CH3OH(g)。在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
CH3OH(g)。在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
①上述合成甲醇的反应为______(填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为___________。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为_____L。
(4)某研究小组设计了如图所示的甲醇燃料电池装置。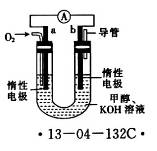
①该电池工作时,OH-向______(填“a”或“b”)极移动。
②电池工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com