
【题目】在下图所示的物质转化关系中,A是常见的气态氢化物,其水溶液呈碱性,B是能使带火星的木条复燃的无色无味气体, G是一种红色金属单质。(部分反应中生成物没有全部列出,反应条件未列出)
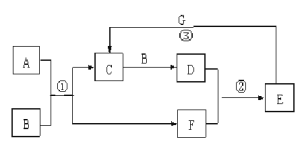
请回答下列问题:
(1)反应①的化学方程式为 。当有1molA参加反应时,转移 mol电子。
(2)反应②的化学方程式为 。
(3)反应③的离子方程式为 。
【答案】(1)4NH3+5O2![]() 4NO+6H2O,5
4NO+6H2O,5
(2)3NO2+H2O=2HNO3+NO
(3)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
【解析】
试题分析:A是常见的气态氢化物,其水溶液呈碱性,A是氨气;B是能使带火星的木条复燃的无色无味气体,B是氧气;氨气发生催化氧化生成NO和水,NO和氧气反应生成NO2,NO2溶于水生成硝酸,则C是NO,F是H2O,D是NO2,E是HNO3,G是一种红色金属单质,因此G是铜。
(1)反应①的化学方程式为4NH3 + 5O2![]() 4NO + 6H2O。氮元素的化合价从-3价升高到+2价,失去5个电子,因此当有1molA参加反应时,转移5mol电子。
4NO + 6H2O。氮元素的化合价从-3价升高到+2价,失去5个电子,因此当有1molA参加反应时,转移5mol电子。
(2)反应②的化学方程式为3NO2+H2O=2HNO3+NO。
(3)反应③的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。


 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.乙烯和苯都能使溴水褪色,褪色的原理相同
B.乙醇、乙酸、乙酸乙酯都能发生取代反应
C.淀粉、油脂、蛋白质的水解产物互为同分异构体
D.纤维素、聚乙烯、光导纤维都属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于脱氧核苷酸的相关说法正确的是( )
A. 化学组成包括磷酸、碱基、脱氧核糖
B. 是一种生物大分子
C. 是生物的主要遗传物质
D. 每一种都含有四种特定的碱基
查看答案和解析>>
科目:高中化学 来源: 题型:
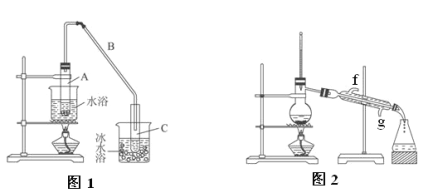
【题目】某化学小组采用类似制乙酸乙酯的装置(图1),用环己醇制备环己烯:
已知: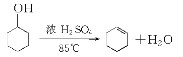
密度(g· cm-3) | 熔点(℃) | 沸点℃ | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品:将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是__________________。
②试管C置于冰水浴中的目的是___________________。
(2)制备精品:
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用____________(填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按图2装置蒸馏,冷却水从________口进入。蒸馏时加入生石灰,目的是__________。
③收集产品时,控制的温度应在__________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是___________(填选项符号)
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是____________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设为阿伏加德罗常数的值。下列说法正确的是
A.1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1![]()
B.标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为5/22.4![]()
C.pH=13的NaOH溶液中含有的OH-为0.1mol
D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 研究碳及其化合物的相互转化对能源的充分利用、低碳经济有着重要的作用。
⑴已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.1kJ·mol-1
CO(g)+3H2(g) △H1=+206.1kJ·mol-1
②2H2(g)+CO(g)![]() CH3OH(l) △H2=-128.3kJ·mol-1
CH3OH(l) △H2=-128.3kJ·mol-1
③2H2(g)+O2(g)![]() 2H2O(g) △H3=-483.6kJ·mol-1
2H2O(g) △H3=-483.6kJ·mol-1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为 。
⑵利用反应①来制备氢气,为了探究温度、压强对反应①速率、转化率的影响,某同学设计了以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa)。
实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/ mol·L-1 | H2O初始浓度/ mol·L-1 |
1 | 400 | p | 3.0 | 7.0 |
2 | t | 101 | 3.0 | 7.0 |
3 | 400 | 101 | 3.0 | 7.0 |
①实验2和实验3相比,其平衡常数关系是K2 K3(填“>”、“<”或“=”)。
②将等物质的量的CH4和水蒸气充入1L恒容密闭容器中,发生上述反应,在400℃下达到平衡,平衡常数K=27,此时容器中CO物质的量为0.10mol,则CH4的转化率为 。
⑶ 科学家提出由CO2制 取 C的太阳能工艺如图1所示。
①“重整系统发生的反应中n(FeO):n(CO2)=6:1,则Fe xOy的化学式为______________。
②“热分解系统”中每分解l mol Fe xOy,转移电子的物质的量为___________。


图1 图2
⑷pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值。若某溶液中溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。如图2为25℃时H2CO3溶液的pC-pH图。请回答下列问题 (若离子浓度小于10-5mol/L,可认为该离子不存在):
①在同一溶液中,H2CO3、HCO3-、CO32-____________(填“能”或“不能”)大量共存。
②求H2CO3一级电离平衡常数的数值Ka1=________________。
③人体血液里主要通过碳酸氢盐缓冲体系![]() 可以抵消少量酸或碱,维持pH=7.4。当过量的酸进入血液中时,血液缓冲体系中的
可以抵消少量酸或碱,维持pH=7.4。当过量的酸进入血液中时,血液缓冲体系中的![]() 最终将_________。
最终将_________。
A.变大 B.变小 C.基本不变 D.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com