
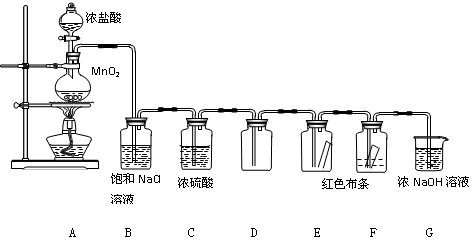
分析 根据实验装置图可知,A装置中用浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,B装置中用饱和食盐水除去氯化氢,再用C装置中浓硫酸干燥,D装置用向上排空法收集氯气,后将干燥的氯气通入E装置中干燥的有色布条,再通入F装置中湿润的有色布条,再用G装置中的氢氧化钠溶液吸收氯气尾气,据此答题.
解答 解:(1)根据装置图可知,A烧瓶中发生的反应为浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,反应的化学方程式为 MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;
(2)根据上面的分析可知,C中盛装的试剂是浓硫酸,作用是除去氯气中的水蒸气,得到干燥的氯气,防止对E中实验的干扰,故答案为:除去氯气中的水蒸气,得到干燥的氯气,防止对E中实验的干扰;
(3)通入Cl2后,E中布条不褪色,F中布条褪色,根据现象可得出的结论是干燥的Cl2没有漂白性,Cl2与水反应的某种产物具有漂白性;
故答案为:E中布条不褪色,F中布条褪色;干燥的Cl2没有漂白性,Cl2与水反应的某种产物具有漂白性;
(4)G中盛有NaOH溶液,其作用是吸收氯气,防止环境污染,反应离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:吸收氯气,防止环境污染;Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查学生对性质实验方案设计题的掌握,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力,侧重实验基本能力和基础知识的考查.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与硫化合时可以发生爆炸 | |
| B. | 等质量的两块钠与足厨氧气分别在加热条件下和常温条件下充分反应失去电子的数目一样多 | |
| C. | 钠着火燃烧时可用泡沫灭火器扑灭 | |
| D. | 工业上可用钠冶炼金属钛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定不含Fe3+和Fe2+ | |
| B. | 一定含有Fe3+,但一定不含Fe2+ | |
| C. | 一定含有Al3+,Fe2+、Fe2+含有一种或两种 | |
| D. | 溶液可能含有NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题.
消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 溶液X中一定含有Iˉ、CO32ˉ、SO42ˉ | |
| B. | 通过在黄色溶液中加入硝酸银溶液可以检验溶液X中是否存在Cl- | |
| C. | 试剂①为硝酸钡溶液 | |
| D. | 通过焰色反应,可确认溶液X中阳离子的种类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S2O7 | B. | H2S2O8 | C. | H2S3O10 | D. | H2S4O13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com