
【题目】实验室如图的装置模拟工业过程制取硫代硫酸钠(夹持仪器和加热仪器均省略)。其反应原理为2Na2S+Na2CO3+4SO2![]() 3Na2S2O3+CO2
3Na2S2O3+CO2
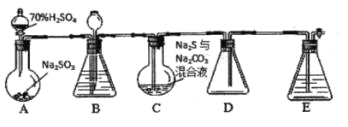
请回答:
(1)下列说法不正确的是___。
A.装置A的烧瓶中的试剂应是Na2SO3固体
B.提高C处水浴加热的温度,能加快反应速率,同时也能增大原料的利用率
C.装置E的主要作用是吸收CO2尾气
D.装置B的作用之一是观察SO2的生成速率,该处锥形瓶中可选用浓硫酸或饱和NaHSO3溶液
(2)反应结束后C中溶液中会含有少量Na2SO4杂质,请解释其生成原因___。
【答案】BC SO2和Na2CO3反应生成Na2SO3,Na2SO3不稳定而易被空气氧化生成Na2SO4,且生成的Na2S2O3也易被空气氧化生成硫酸钠
【解析】
A装置制取二氧化硫,发生的反应离子方程式为SO32﹣+2H+=SO2↑+H2O,B装置能储存二氧化硫且起安全瓶的作用,还能根据气泡大小控制反应速率,C装置中发生反应2Na2S+Na2CO3+4SO2![]() 3Na2S2O3+CO2,剩余的二氧化硫有毒,不能直接排空,所以E为尾气处理装置,结合题目分析解答。
3Na2S2O3+CO2,剩余的二氧化硫有毒,不能直接排空,所以E为尾气处理装置,结合题目分析解答。
(1)A.装置A的烧瓶中的试剂应是Na2SO3固体,分液漏斗中盛放的液体是硫酸,二者在A中发生反应生成二氧化硫,故A正确;
B.提高C处水浴加热的温度,能加快反应速率,但是气体流速也增大,导致原料利用率减少,故B错误;
C.装置E的主要作用是吸收SO2尾气,防止二氧化硫污染环境,故C错误;
D.装置B的作用之一是观察SO2的生成速率,该处锥形瓶中可选用浓硫酸或饱和NaHSO3溶液,二者都不溶解或与二氧化硫反应,所以可以选取浓硫酸或饱和亚硫酸氢钠溶液,故D正确;故答案为:BC;
(2)反应结束后C中溶液中会含有少量Na2SO4杂质,SO2和Na2CO3反应生成Na2SO3,Na2SO3不稳定而易被空气氧化生成Na2SO4,且生成的Na2S2O3也易被空气氧化生成硫酸钠,所以得到的物质中含有少量Na2SO4,故答案为:SO2和Na2CO3反应生成Na2SO3,Na2SO3不稳定而易被空气氧化生成Na2SO4,且生成的Na2S2O3也易被空气氧化生成硫酸钠。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示,活化氧可以快速氧化二氧化硫。下列说法错误的是

A. 氧分子的活化包括O-O键的断裂与C-O键的生成
B. 每活化一个氧分子放出0.29eV的能量
C. 水可使氧分子活化反应的活化能降低0.42eV
D. 炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,0.1mol L-1NaOH溶液中,Kw=__;pH=__。
(2)氯化铁水溶液呈___(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):__。实验室在配制氯化铁溶液时,常将氯化铁固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,是为了___(填“促进”、“抑制”)氯化铁水解。
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈__(填“酸性”,“中性”或“碱性”),溶液中c(Na+ )___c(CH3COO-)(填“>”,“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20.00mL0.100molL-1的氨水和醋酸铵溶液中分别滴加0.100molL-1的盐酸溶液,溶液pH随加入盐酸体积的变化如图所示。下列说法不正确的是( )
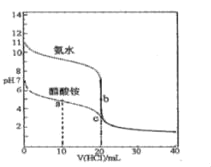
A.25℃时,Kb(NH3H2O)=Ka(CH3COOH)≈10-5
B.b点溶液中水的电离程度比c点溶液中的大
C.在c点的溶液中:c(Cl﹣)>c(CH3COOH)>c(NH4+)>c(OH﹣)
D.在a点的溶液中:c(NH4+)+2c(H+)═2c(CH3COO-)+c(NH3H2O)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备己二酸的原理为:3![]() +8KMnO4═3KOOC(CH2)4COOK+8MnO2↓+2KOH+5H2O
+8KMnO4═3KOOC(CH2)4COOK+8MnO2↓+2KOH+5H2O
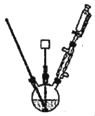
主要实验装置和步骤如下:
①在如图装置中加入5mL10%氢氧化钠溶液和50mL水,搅拌使其溶解,然后加入6.3g高锰酸钾,小心预热溶液到40℃。
②从恒压漏斗中缓慢滴加1.4mL环己醇,控制滴速,使反应温度维持在45℃左右,反应20min后,再在沸水浴上加热5min促使反应完全并使MnO2沉淀凝聚。
③加入适量亚硫酸氢钠固体除去多余高锰酸钾。
④通过___操作,得到沉淀和滤液,洗涤沉淀2~3次,将洗涤液合并入滤液。
⑤加热浓缩使溶液体积减少至10mL左右,趁热小心加入浓硫酸,使溶液呈强酸性(调节pH=1~2),冷却结晶、抽滤、洗涤、干燥,得己二酸白色晶体1.5g。
已知:己二酸的电离平衡常数:Ka1=3.8×10﹣5,Ka2=3.9×10-6;相对分子质量为146;其在水中溶解度如下表
温度(℃) | 15 | 34 | 50 | 70 | 87 | 100 |
己二酸溶解度(g) | 1.44 | 3.08 | 8.46 | 34.1 | 94.8 | 100 |
(1)步骤②中缓慢滴加环己醇的原因是___。
(2)步骤④划线部分操作是___、在第④、⑤布中均要求洗涤沉淀,所用洗涤液依次为___、___。
(3)步骤⑤加入浓硫酸调节pH成强酸性的原因是___。
(4)己二酸产品的纯度可用酸碱滴定法测定。取样试样ag(准确至0.0001g),置于250mL锥形瓶中,加入50mL除去CO2的热蒸馏水,摇动使试样完全溶解,冷却至室温,滴加3滴酚酞溶液,用0.1000molL-1的NaOH标准溶液滴定至微红色即为终点,消耗NaOH标准溶液体积bmL
①下列说法正确的是___。
A.称取己二酸样品质量时,先将锥形瓶放在电子天平秤盘的中央,显示数字稳定后按“去皮”键(归零键),再缓慢加样品至所需样品的质量时,记录称取样品的质量
B.摇瓶时,应微动腕关节,使溶液向一个方向做圆周运动,但是勿使瓶口接触滴定管,溶液也不得溅出
C.滴定时左手轻轻挤压玻璃球让液体自行呈线状流下
D.滴定结束后稍停1﹣2分钟,等待滴定管内壁挂有的溶液完全流下时再读取刻度数
E.记录测定结果时,滴定前仰视刻度线,滴定到达终点时又俯视刻度线,将导致滴定结果偏高
②计算己二酸纯度的表达式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42—,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A.Cl-、Br-、CrO42—B.CrO42—、Br-、Cl-C.Br-、Cl-、CrO42— D.Br-、CrO42—、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,若在![]() 恒容密闭容器中,投入等物质的量的CO和
恒容密闭容器中,投入等物质的量的CO和![]() ,发生可逆反应:
,发生可逆反应:![]() ,至2min时容器内含有
,至2min时容器内含有![]()
![]() ,以下有关描述正确的是
,以下有关描述正确的是
①达平衡过程中,CO和![]() 的物质的量之比始终保持不变
的物质的量之比始终保持不变
②达平衡过程中,![]() 和Fe的物质的量之比始终保持不变
和Fe的物质的量之比始终保持不变
③![]() 内,以CO表示该反应的化学反应速率为
内,以CO表示该反应的化学反应速率为![]()
④![]() 内,以
内,以![]() 表示该反应的化学反应速率为
表示该反应的化学反应速率为![]()
A.①②B.②③C.③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1 mol·L-1,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是
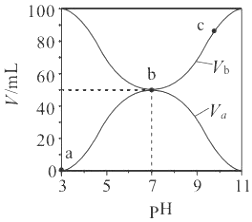
A. Ka(HA)=1×10-6
B. b点c(B+)=c(A-)=c(OH-)=c(H+)
C. a→c过程中水的电离程度始终增大
D. c点时,c(A-)/[c(OH-)c(HA)]随温度升高而减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下列热化学方程式:
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1=+260kJ/mol
2CO(g)+O2(g)=2CO2(g) △H2=-566kJ/mol
请写出用CH4与O2反应生成CO和H2的的热化学方程式______________。
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g),其化学平衡常数K与t的关系如下表,请完成下列问题:
2NH3(g),其化学平衡常数K与t的关系如下表,请完成下列问题:
t/K | 298 | 398 | 498 |
K/(mol/L)-2 | 4.1×106 | K1 | K2 |
①比较K1、K2的大小,K1__________K2(填写“>”“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据的是_________(填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1:3:2 B.3v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
③若上述反应达到平衡时,N2、H2、NH3的浓度之比为1:3:2,再向容器中按物质的量之比1:3:2通入N2、H2、NH3,与原平衡相比,N2的物质的量浓度______(填“增大”或“减小”或“不变”,下同),NH3的体积分数__________。
(3)高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H>0。
Fe(s)+CO2(g) △H>0。
①其平衡常数可表示为_____________。
②已知1100℃时K=0.263,1100℃时测得高炉中c(CO2)=0.025 mol/L,c(CO)=0.1mol/L,此时CO气体的转化率为_________(用百分数表示),该反应是否处于化学平衡状态____(选填“是”或“否”),此时,化学反应速率是υ正____υ逆(选填“大于”、“小于”或“等于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com