
| A. | 16O2与18O2互为同位素,它们的性质基本相同 | |
| B. | 多糖、油脂、蛋白质在一定条件都能发生水解反应 | |
| C. | 玻璃、陶瓷、水泥都是硅酸盐产品,属于无机非金属材料 | |
| D. | 高纯硅广泛应用于太阳能电池、计算机芯片 |
分析 A.有相同质子数,不同中子数的原子互为同位素;同位素原子的化学性质基本相同;
B.多糖可水解生成单糖,油脂中含有酯基,蛋白质含有肽键;
C.水泥、玻璃、陶瓷是传统的无机非金属材料;
D.高纯硅是优良的半导体材料.
解答 解:A.16O2与18O2都是分子,不是原子,故不能互为同位素,它们的物理性质不同,化学性质基本相同,故A错误;
B.多糖可水解生成单糖,油脂中含有酯基,可水解生成甘油和高级脂肪酸,蛋白质含有肽键,可水解生成氨基酸,故B正确;
C.水泥、玻璃、陶瓷都是硅酸盐产品,属于传统的无机非金属材料,故C正确;
D.高纯硅是优良的半导体材料,广泛应用于太阳能电池、计算机芯片,故D正确;
故选A.
点评 本题主要考查同位素的概念和性质、有机物的水解、无机非金属材料、硅单质的应用等,难度不大.要注意相关基础知识的积累.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 8 | C. | 12 | D. | 16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L氯气溶于水转移电子数为NA | |
| B. | 1L 0.1mol/L的硫酸铁溶液中含有铁离子的数目为0.2NA | |
| C. | 向氨气合成塔中通入amolN2和3amolH2的混合气,充分反应后生成N-H数为6aNA | |
| D. | 电解硫酸铜溶液时,当阳极产生22.4L(标况)气体,体系中转移电子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E五种短周期元素,A、C同周期,B、D同主族,E是五种元素中原子半径最小的元素.A是构成矿物和岩石的主要成分的元素,C、D可生成离子化合物C3D2.A的单质与E的单质在常温下就可发生反应,生成化合物F.据此回答下列问题:
有A、B、C、D、E五种短周期元素,A、C同周期,B、D同主族,E是五种元素中原子半径最小的元素.A是构成矿物和岩石的主要成分的元素,C、D可生成离子化合物C3D2.A的单质与E的单质在常温下就可发生反应,生成化合物F.据此回答下列问题: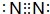 ;A单质及其最高价氧化物均属于原子晶体(填晶体类型)
;A单质及其最高价氧化物均属于原子晶体(填晶体类型)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
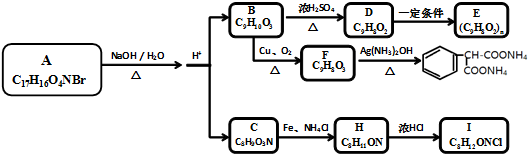
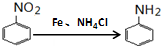
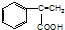 ,C→H的反应类型是还原反应.
,C→H的反应类型是还原反应.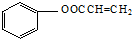 ,
,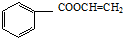 .
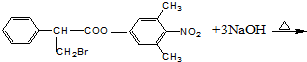
.
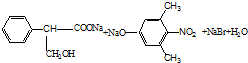 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
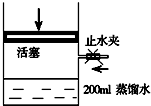
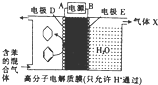 一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )
一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )| A. | A为电源的正极 | |
| B. | 气体X为H2 | |
| C. | 电极E为阴极 | |
| D. | 电极D的电极反应式为C6H6+6H++6e-=C6H12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由SO2制亚硫酸钠:SO2$\stackrel{Na_{2}CO_{3}溶液}{→}$NaHSO3溶液$→_{调节溶液的pH}^{NaOH溶液}$Na2SO3溶液 | |
| B. | 由NaCl制漂白粉精:NaCl(aq)$\stackrel{电解}{→}$Cl2$\stackrel{澄清石灰水}{→}$漂粉精 | |
| C. | 由NH3制硝酸:NH3$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| D. | 由乙烯制乙酸:H2C=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH$→_{△}^{CuO_{2}}$CH3CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
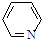 ),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强.
),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com