
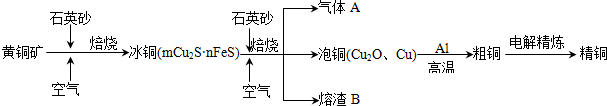
分析 (1)由流程图转化可知,气体A中的大气污染物主要是二氧化硫,选择试剂吸收二氧化硫,不能产生新的污染气体,二氧化硫是酸性氧化物,结合选项中各物质的性质判断;
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明含有Fe3+;Fe2+具有还原性,可以利用KMnO4溶液检验;
(3)由流程图转化可知,Cu2O与Al反应置换反应生成Al2O3与Cu;
(4)根据原电池原理,正极发生的是化合价降低得电子的反应.
解答 解:(1)由流程图转化可知,气体A中的大气污染物主要是二氧化硫,选择试剂吸收二氧化硫,不能产生新的污染气体,
a.浓H2SO4不能吸收二氧化硫,故a错误;
b.稀HNO3可以吸收二氧化硫,但生成NO污染大气,故b错误;
c.NaOH溶液与二氧化硫反应生成亚硫酸钠和水,不产生新的污染气体,故c正确;
d.氨水与二氧化硫反应生成亚硫酸铵,不产生新的污染气体,故d正确;故答案为:c、d;
(2)Fe3+遇KSCN溶液变为血红色,用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明含有Fe3+;Fe2+具有还原性,可以利用KMnO4溶液检验,取少量溶液,滴加KMnO4溶液,KMnO4溶液紫色褪去,故答案为:Fe3+;取少量溶液,滴加KMnO4溶液,KMnO4溶液紫色褪去,则溶液中存在Fe2+;
(3)由流程图转化可知,Cu2O与Al反应置换反应生成Al2O3与Cu,反应方程式为3Cu2O+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+6Cu,故答案为:3Cu2O+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+6Cu;
(4)原电池正极发生的是化合价降低得电子的反应,根据方程式可知是O2得电子,另外,由于H2SO4存在,所以发生的O2酸性条件下的电极反应:4H++O2+4e-═2H2O,故答案为:4H++O2+4e-═2H2O.
点评 本题考查了元素化合物铜、氮、铁、硫的性质,掌握常见离子的检验是解答本题的关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | vA=0.5 mol•L-1•s-1 | B. | v B=0.5 mol•L-1•s-1 | ||
| C. | vC=0.4 mol•L-1•s-1 | D. | vD=1.2 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
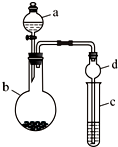 某课外小组同学设计了如图所示装置(夹持、加热仪器省略)进行系列实验.请根据下列实验回答问题:
某课外小组同学设计了如图所示装置(夹持、加热仪器省略)进行系列实验.请根据下列实验回答问题: +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr.向c中滴加AgNO3溶液,可观察到的现象是产生浅黄色沉淀.
+HBr.向c中滴加AgNO3溶液,可观察到的现象是产生浅黄色沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | ||||
| Y | Z | W |
 .
.| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质遇浓硫酸变为黄色 | B. | 蔗糖水解产物仅有葡萄糖 | ||
| C. | 纤维素不能水解成葡萄糖 | D. | 油脂水解产物之一是甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂的水解反应又叫做皂化反应 | |
| B. | 一定条件下,糖类都能发生水解反应 | |
| C. | 蛋白质发生变性后,直接生成氨基酸 | |
| D. | 通过灼烧时产生的气味可以鉴别蚕丝和棉纱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
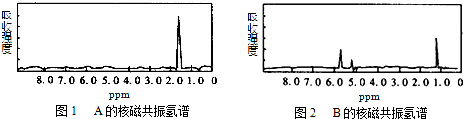
| A. | A是C3H6、B是C2H6 | B. | A是C6H6、B是C4H6 | C. | A是C6H6、B是C2H6 | D. | A是C3H8、B是C6H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05mol | B. | 0.13mol | C. | 1.05mol | D. | 1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验内容 | 实验目的 |
| A | 向盛有10滴0.1 mol/LAgNO3溶液的试管中滴加0.1 mol/NaCl容液,至不再有沉淀生成,再向其中滴加0.lmol/LNa2S 溶液 | 证明在相同温度下,溶解度:AgCl>Ag2S |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO2溶液中存在水解平衡 |
| C | 分别向2mL甲苯、2mL苯、2niL正己烷中加入 3滴酸性高锰酸钾溶液,振荡,甲苯中酸性高锰酸钾溶液褪色,而苯、正己烷中酸性高锰酸钾溶液不褪色 | 证明与苯环相连的甲基易被氧化 |
| D | 取两只试管,分别加入4mL0.01mol/L KMn04酸性溶液,然后向一只试管中加入0.1mol/LH2C2O4溶液2mL,向另一只试管中加入0.1mol/LH2C2O4液4mL记录褪色时间 | 证明草酸浓度越大反应速率越快 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com