
【题目】把V L含有MgSO4和Al2(SO4)3的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使铝离子完全转化为AlO2﹣(1mol铝离子消耗4molNaOH生成1mol AlO2﹣);另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为BaSO4 . 则原混合溶液中Mg2+的浓度为( )
A.![]() mol?L﹣1
mol?L﹣1
B.![]() mol?L﹣1
mol?L﹣1
C.![]() mol?L﹣1
mol?L﹣1
D.![]() mol?L﹣1
mol?L﹣1
【答案】C
【解析】解:混合溶液分成两等份,每份溶液浓度相同,设每份溶液中含有Mg2+、Al3+的物质的量分别为x、y,一份加入含a mol NaOH的溶液,恰好使铝离子完全转化为AlO2﹣ , 则:①2x+4y=amol,另一份加入含bmol BaCl2的溶液,恰好使硫酸根离子完全沉淀为BaSO4 , 根据钡离子与硫酸根守恒可知该份中n(SO ![]() )=BaSO4=n(BaCl2)=bmol;
)=BaSO4=n(BaCl2)=bmol;
由电荷守恒可知每份中:2n(Mg2+)+3n(Al3+)=2(SO ![]() ),即:②2x+3y=2bmol,
),即:②2x+3y=2bmol,
联立①②解得:x= ![]() mol、y=(a﹣2b)mol,
mol、y=(a﹣2b)mol,
每份溶液的体积为0.5Vl,则每份混合溶液中Mg2+的浓度为:c(Mg2+)= 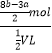 =
= ![]() mol/L,
mol/L,
溶液具有均一性,则原混合液中镁离子的浓度为 ![]() mol/L,
mol/L,
故选C.


科目:高中化学 来源: 题型:
【题目】下列电离方程式错误的是( )
A.NaHCO3═Na++H++CO ![]()
B.NaHSO4(溶液)═Na++H++SO ![]()
C.MgCl2═Mg2++2Cl﹣
D.Ba(OH)2═Ba2++2OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCO3与砂糖混用可以作补血剂,实验室里制备FeCO3的流程如图所示.下列说法错误的是( ) 
A.产品FeCO3在空气中高温分解可得到纯净的FeO
B.可利用KSCN溶液检验FeSO4溶液是否变质
C.沉淀过程中有CO2气体放出
D.检验沉淀是否洗涤干净可用盐酸酸化的BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂废水中含KCN,其浓度为0.01molL﹣1 , 现用氯氧化法处理,发生如下反应(化合物中N化合价均为﹣3价):
(1)KCN+2KOH+Cl2═KOCN+2KCl+H2O被氧化的元素是 . (用元素符号表示)
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
KOCN+Cl2+═K2CO3+N2+KCl+ .
(3)若将10L含KCN的浓度为0.01molL﹣1的废水中KCN氧化除去,最少需要氯气mol.
(4)某实验小组为了测定(3)中溶液多余Cl2的含量,常用Na2S2O3标准溶液进行定量测定.现实验室需用480mL一定浓度的Na2S2O3溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需
(5)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42﹣ , 因此Na2S2O3常用作脱氯剂,该反应的离子方程式为 .
(6)现取(3)中溶液20.00mL,用amolL﹣1 Na2S2O3溶液进行滴定,经过平行实验测得消耗Na2S2O3标准溶液b mL,计算废液中Cl2的浓度为molL﹣1 (用含a、b的表达式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在银锌原电池中,以硫酸铜为电解质溶液,锌为极,电极上发生的是反应(“氧化”或“还原”),电极反应式为 , 锌片上观察到的现象为;银电极上的电极反应式是 , 银片上观察到的现象是 . 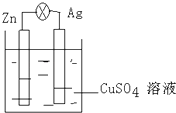
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题: 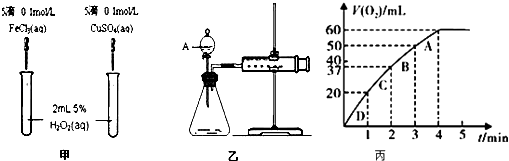
(1)定性分析:如图甲可通过观察现象,定性比较得出结论.有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.图中仪器A的名称为 , 实验中需要测量的数据是 .
(3)加入0.10mol MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示. ①实验时放出气体的总体积是mL.
②A、B、C、D各点反应速率快慢的顺序为>>> .
③解释反应速率变化的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,6﹣已二酸(G)是合成尼龙的主要原料之一,可用含六个碳原子的有机化合物氧化制备.如图为A通过氧化反应制备G的反应过程(可能的反应中间物质为B、C、D、E和F): 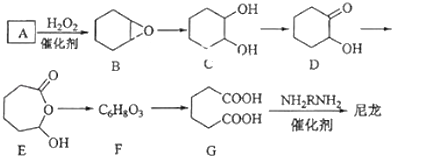
回答下列问题:
(1)化合物A中含碳87.8%,其余为氢,A的化学名称为 .
(2)B到C的反应类型为 .
(3)F的结构简式为 .
(4)在上述中间物质中,核磁共振氢谱出峰最多的是 , 最少的是 . (填化合物代号)
(5)由G合成尼龙的化学方程式为 .
(6)由A通过两步反应制备1,3﹣环已二烯的合成路线为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com