
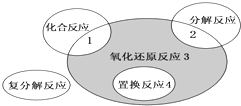
 氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影3区域的是 ( )
氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影3区域的是 ( )| A. | Cl2+2NaI═2NaCl+I2 | B. | CH4+2O2═CO2+2H2O | ||
| C. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | D. | 2H2O2═2H2O+O2↑(MnO2催化下) |
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | D是氢的一种核素,原子核内有2个中子 | |
| B. | 1H218O与D216O的相对分子质量相同 | |
| C. | 3H2O与D2O互称同位素 | |
| D. | 通过化学变化可以直接实现普通水向重水转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 3 | C. | 2 | D. | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,22 gCO2 中含有NA个氧原子 | |
| B. | 1mol/L CaCl2溶液中Cl-的数目等于2NA | |
| C. | 标准状况下,33.6LCH4中含H原子数为6NA | |
| D. | 1ol Na 完全反应时,失去NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原X、Y混合气体积为1.2VL | B. | 原X、Y混合气体积为1.1VL | ||
| C. | 达平衡时,消耗X体积为0.25VL | D. | 达平衡时,消耗Y体积为0.05VL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数减小 | B. | BaO量不变 | C. | 氧气浓度不变 | D. | 平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com