
下列叙述正确的是( )
A. 和
和  均是芳香烃,
均是芳香烃, 既是芳香烃又是芳香化合物
既是芳香烃又是芳香化合物
B.分子式为C3H6Cl2的有机物共有5种同分异构体(不考虑立体异构)
C. 分子式为C4H8有机物最多存在4个C—C单键
D.分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可推测有机物结构简式为C2H5-OH
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
常温下,用 0.01 mol·L-1 NaOH溶液滴定 20.00 mL 0.01 mol·L-1 CH3COOH溶液,所得滴定曲线如右图。下列说法正确的是
A.a点对应溶液的pH=2
B.b点对应的溶液中:
c(OH-)+ c(CH3COO-) = c(Na+)+ c(H+)
C.c点表示NaOH溶液与CH3COOH溶液恰好完全反应
D.d点对应的溶液中,水的电离程度小于同温下纯水的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法或表达正确的是( )
A.氢氧化钠、氯化氢气体、氯化银都是电解质
B.AlCl3的熔点仅190 ℃而Al2O3的熔点为2050 ℃,因此熔融电解法冶炼铝使用AlCl3比Al2O3更好
C.向沸腾的NaOH溶液中滴加FeCl3饱和溶液, 可以制备Fe(OH)3胶体
D.足量氯气通入溴化亚铁溶液中:2Fe2++Cl2=2Cl-+2Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物的天然提取和人工合成往往得到的是混合物,假设给你一种这样的有机混合物
让你研究,一般要采取的几个步骤是 ( )
A.分离、提纯→确定分子式→确定实验式→确定结构式
B.分离、提纯→确定实验式→确定分子式→确定结构式
C.分离、提纯→确定结构式→确定实验式→确定分子式
D.确定分子式→确定实验式→确定结构式→分离、提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于丙烯(CH3—CH =CH2)的说法正确的是 ( )
A、丙烯分子有7个δ键,1个π键。
B、丙烯分子中3个碳原子都是sp3杂化。
C、丙烯分子中所有原子在同一平面上
D、丙烯能使酸性高锰酸钾褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机化合物仅由碳、氢、氧三种元素组成 ,经测定其相对分子质量为90 。称取该有机物样品1.8 g ,在足量纯氧中完全燃烧 ,将产物先后通过浓硫酸和碱石灰 ,两者分别增重1.08 g和2.64 g 。
(1)通过计算得出该有机化合物的分子式为 (简要写出计算过程 )
(2)经过红外光谱分析得知该分子中存在C=O C-O C-H 等化学键,且核磁共振氢谱中只有一组峰,该有机物的结构简式为
查看答案和解析>>
科目:高中化学 来源: 题型:
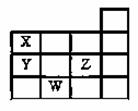
右图表示元素周期表中1~4周期的一部分,关于元素X、Y、Z、W 的 叙述错误的是 ( )
A.X、Y的最高价氧化物的水化物酸性为Y<X
B.Y、Z的气态氢化物的稳定性为Y<Z
C.Z有5种不同运动状态的电子
D.W的原子序数比Y大19
查看答案和解析>>
科目:高中化学 来源: 题型:
石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示(部分仪器已略在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水。
实验现象:试管①中加热一段时间后,可以看到试管内液体沸腾;
试管②中有少量液体凝结,闻到汽油的气味,往液体中滴加几滴高锰酸钾酸性溶液颜色褪去。根据实验现象回答下列问题:
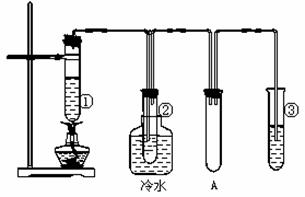
(1) 装置A的作用是______________________________
(2) 试管①中发生的主要反应有:C17H36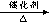 C8H18+C9H18 C8H18
C8H18+C9H18 C8H18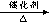 C4H10+C4H8
C4H10+C4H8
丁烷可进一步裂解,除得到甲烷和乙烷外,还可以得到另两种有机物,它们的结构简式为_____________和________________,这两种有机物混合后在一定条件下可聚合成高分子化合物,其反应类型属于________反应。其可能结构为( )(答案可能不止一个,下同)
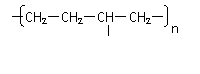
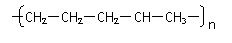 A、 B、
A、 B、
C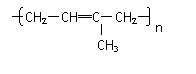
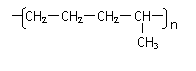
、 D、
(3)写出试管③中反应的一个化学方程式_____________________________,该反应的类型为__________反应。
(4)试管②中的少量液体的组成是____________(填序号)
①甲烷 ②乙烯 ③液态烷烃 ④液态烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
氨在国民经济中占有重要地位。
(1)工业合成氨时,合成塔中每产生1 mol NH3,放出46.1 kJ的热量。
① 工业合成氨的热化学方程式是 。

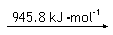 ② 已知:
② 已知:
N2 (g) 2N (g)
H2 (g) 2H (g)
则断开1 mol N-H键所需的能量是_______kJ。
(2)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
|

① 曲线a对应的温度是 。
② 关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A.及时分离出NH3可以提高H2的平衡转化率
B.加催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、N、Q点平衡常数K的大小关系是K(M)= K(Q) >K(N)
③ M点对应的H2转化率是 。
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
4NH3(g) + 3O2(g) == 2N2(g) + 6H2O(g)。
则该燃料电池的负极反应式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com