
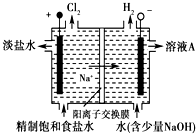
 氯碱工业中电解饱和食盐水的原理示意图如图所示
氯碱工业中电解饱和食盐水的原理示意图如图所示分析 (1)依据装置图中氯气和氢气生成的位置判断,生成氯气的电极为阳极,左边为正极,右边为负极,连接电极为阴极,溶液中氢离子在阴极得到电子生成氢气,氢氧根离子浓度增大,溶液A为氢氧化钠溶液;
(2)电解饱和食盐水,依据电极反应判断生成产物,书写离子方程式.
解答 解:(1)装置图中氯气和氢气生成的位置判断,生成氯气的电极为阳极,左边电极为正极,右边电极为负极,连接电极为阴极,溶液中氢离子在阴极得到电子生成氢气,氢氧根离子浓度增大,溶液A为氢氧化钠溶液,故答案为:NaOH;
(2)电解饱和食盐水,溶液中的氯离子在阳极失电子生成氯气,氢离子在阴极得到电子生成氢气,阴极附近氢氧根离子浓度增大生成氢氧化钠,反应的离子方程式:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
点评 本题考查了电解池原理的分析应用,主要是电极反应,电极判断,题目难度中等.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 人们对苯的认识有一个不断深化的过程.
人们对苯的认识有一个不断深化的过程.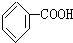 )和石灰的混合物得到液体,命名为苯,写出苯甲酸钠与NaOH共热生成苯的化学方程式:
)和石灰的混合物得到液体,命名为苯,写出苯甲酸钠与NaOH共热生成苯的化学方程式: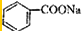 +NaOH$→_{△}^{氧化钙}$Na2CO3+
+NaOH$→_{△}^{氧化钙}$Na2CO3+ .
.
 )脱
)脱查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯(溴):加入CCl4后振荡,然后分液 | |
| B. | 乙酸乙酯(乙酸):加入乙醇和浓硫酸并加热 | |
| C. | 乙烷(乙烯):通过足量溴水 | |
| D. | NaCl溶液(淀粉):过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 苯(苯酚):加浓溴水振荡,过滤 | |
| B. | 乙酸乙酯(乙酸):加入乙醇和浓硫酸并加热 | |
| C. | 乙醇(水):加入生石灰,蒸馏 | |
| D. | 淀粉溶液(葡萄糖):渗析 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
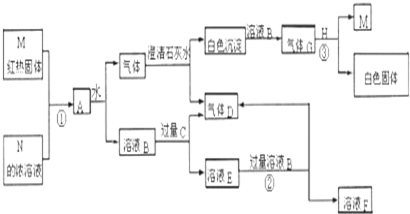
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
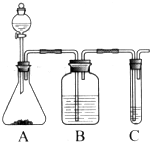 Ⅰ.实验室常用如图中的装置制备乙炔并检验乙炔的性质
Ⅰ.实验室常用如图中的装置制备乙炔并检验乙炔的性质 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
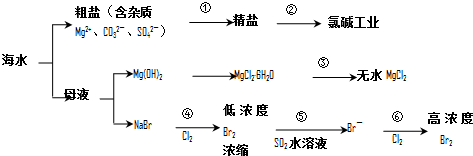
| A. | 过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 | |
| B. | 在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 在过程④、⑥反应中每氧化0.2 mol Br-需消耗2.24LCl2 | |
| D. | 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com