
分析 NO和水不反应,3NO2+H2O=2HNO3+NO,所以NO 和NO2 的混合气体通过水吸收后,得到的无色气体是NO;一氧化氮、氧气和水反应方程式为:4NO+3O2+2H2O=4HNO3,该反应中NO和O2的体积之比为4:3,则NO与等体积的O2 混合,通过水充分吸收后,氧气有剩余,所以得到的无色气体B是氧气,根据4NO+3O2+2H2O=4HNO3知,等体积的一氧化氮和氧气、水反应后,剩余的氧气占氧气总体积的$\frac{1}{4}$,据此计算出NO体积,气体A和氧气的体积相等,据此可知NO气体,据此进行解答.
解答 解:(1)NO和水不反应,3NO2+H2O=2HNO3+NO,所以NO 和NO2 的混合气体通过水吸收后,得到的无色气体是NO;一氧化氮、氧气和水反应方程式为:4NO+3O2+2H2O=4HNO3,该反应中NO和O2的体积之比为4:3,则NO与等体积的O2 混合,通过水充分吸收后,氧气有剩余,所以得到的无色气体B是氧气,
根据4NO+3O2+2H2O=4HNO3知,等体积的一氧化氮和氧气、水反应后,剩余的氧气占氧气总体积的$\frac{1}{4}$,所以氧气的总体积是:$\frac{5mL}{\frac{1}{5}}$=20mol,气体A和氧气的体积相等,所以也是20mL,
故答案为:NO;20;
(2)根据分析可知,发生反应的化学方程式有:3NO2+H2O=2HNO3+NO、4NO+3O2+2H2O=4HNO3,
故答案为:3NO2+H2O=2HNO3+NO、4NO+3O2+2H2O=4HNO3.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,注意熟练掌握一氧化氮、二氧化氮的化学性质,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 比较钾、钠:Na、K、H2O | |
| B. | 比较镁、铝:MgCl2溶液、AlCl3溶液、NaOH溶液 | |
| C. | 比较硫、氯:Na2S溶液、NaCl溶液、pH试纸 | |
| D. | 比较溴、碘:溴水、KI淀粉试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
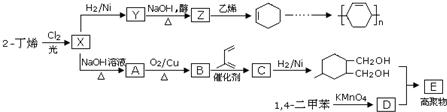
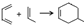 .
.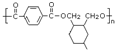 ;甲是A的一种同分异构体,其能实现转化:
;甲是A的一种同分异构体,其能实现转化: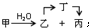 ,甲的名称为乙酸乙酯;
,甲的名称为乙酸乙酯; 可以合成
可以合成  .按合成路线的顺序,涉及反应的反应类型有:加成、消去、加聚.
.按合成路线的顺序,涉及反应的反应类型有:加成、消去、加聚.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
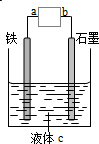
| A. | a、b接电流表,该装置为原电池 | |
| B. | a、b接直流电源,该装置为电解池 | |
| C. | a、b接直流电源,铁可能不易被腐蚀 | |
| D. | a、b接电流表或接直流电源,铁都可能是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途.
氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
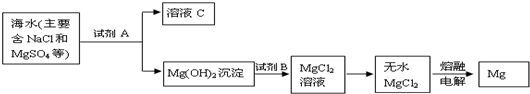
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度时,KW=10-12,此温度下PH=6的溶液一定显酸性 | |
| B. | 25℃时,0.1mol/L的NaHSO3溶液pH=4,说明HSO3-在水溶液中只存在电离 | |
| C. | NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用 | |
| D. | 稀释 0.1mol/L CH3COONa溶液过程中,c(OH-)/c(CH3COO-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下甲能与氢气直接化合,乙不能 | |
| B. | 甲的氧化物对应的水化物酸性比乙强 | |
| C. | 甲得到电子能力比乙强 | |
| D. | 甲、乙形成的化合物中,甲显负价,乙显正价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com