
科目:高中化学 来源: 题型:阅读理解

 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+| CO | 2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
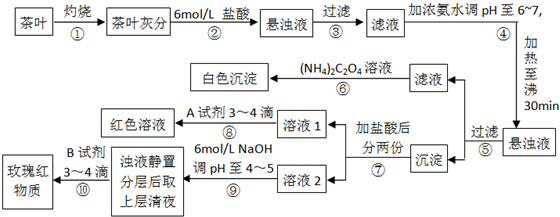
| A、步骤②加入6mol/L盐酸的主要目的是为了将茶叶灰分中的钙、铁、铝难溶性化合物转化为可溶性氯化物 | B、步骤⑤所得滤液中溶质的主要成分为:CaCl2、NH3?H2O | C、步骤⑥可以检出钙元素存在,离子反应方程式为Ca2++C2O42-═CaC2O4↓ | D、步骤⑧中A试剂为KSCN溶液,离子反应方程式为Fe3++3SCN-?Fe(SCN)3 |
查看答案和解析>>
科目:高中化学 来源:河北省冀州中学2012届高二上学期第二次月考(化学)doc 题型:填空题
(8分)(1)10mLpH=5的盐酸,稀释1000倍时,pH__________。
(2)常温下,pH=5和pH=3的盐酸溶液等体积混合后溶液的pH=_________。
(3) 某温度(t℃)时,水的KW=10-13,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,若所得混合溶液为中性,则a:b=_________;
若所得混合溶液pH=2,则a:b=__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com