
下列元素一定是主族元素的是( )
A.原子核外N电子层上只有一个电子的元素
B.原子核外M层电子数为偶数的元素
C.原子核外M层电子数为奇数的元素
D.原子核外N层电子数为2的元素
科目:高中化学 来源: 题型:阅读理解
 A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半 径最小,A、D伺主族,可形成离子化合物DA;C、F同主族,可形成FC2,FC3两种分子B,D,E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元 素.请填写下列空白:
A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半 径最小,A、D伺主族,可形成离子化合物DA;C、F同主族,可形成FC2,FC3两种分子B,D,E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元 素.请填写下列空白:查看答案和解析>>
科目:高中化学 来源:2013届黑龙江省高一下学期期中考试化学试卷 题型:选择题
下列说法正确的是
A.原子最外层电子数为2的元素一定处于周期表IIA族
B.主族元素Y、X能形成XY2型化合物,则Y与X的原子序数之差可能为1
C.同周期IIA族与ⅢA族元素原子序数一定相差1
D.元素周期表中金属元素与非金属元素的分界线附近的一些元素常用于制催化剂
查看答案和解析>>
科目:高中化学 来源:内江二模 题型:问答题
| 1 |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
有关元素X、Y、Z、D、E的信息如下
| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074 nm。 |
| Y | 所在主族序数与所在周期序数之差为4。 |
| Z | 原子半径为0.102 nm,核外最外层电子数是其电子层数的2倍,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰。 |
| D | 最高价氧化物对应的水化物,能电离出离子数、电子数都相等的阴、阳离子。 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏。 |
请回答下列问题:
⑴.X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为 ▲ 。
⑵.E元素与Y元素可形成EY2和EY3两种化合物,下列说法不正确的是 ▲ 。(填序号)
①.保存EY2溶液时,需向溶液加入少量E单质。
②.通常实验室配制EY3溶液时,直接用水溶解EY3固体即可。
③.EY2只能通过置换反应生成,EY3只能通过化合反应生成。
④.铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒。
⑤.向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴EY3的浓溶液,原无色溶液都可变为紫色。
⑶.用化学符号表示D2Z的水溶液中各离子浓度从大到小的顺序是 ▲ 。
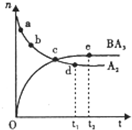
 ⑷.将一定量的Y单质通入一定浓度的苛性钾溶液中,两者恰
⑷.将一定量的Y单质通入一定浓度的苛性钾溶液中,两者恰
好完全反应(已知反应过程放热),生成物中有三种含Y元
素的离子,其中两种离子的物质的量(n)与反应时间(t)
的变化示意图如右图所示。
则该苛性钾溶液中所含KOH的质量是 ▲ g,
该反应中转移电子的物质的量是 ▲ mol。
查看答案和解析>>
科目:高中化学 来源:2011年四川省广安内江市高考化学二模试卷(解析版) 题型:解答题
 ,放出的热量为Q kJ.则该反应的热化学方程式为______.
,放出的热量为Q kJ.则该反应的热化学方程式为______.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com