
 甲醇是重要的化学工业基础原料和清洁液体燃料,工业上常利用CO来制备甲醇.
甲醇是重要的化学工业基础原料和清洁液体燃料,工业上常利用CO来制备甲醇.| 容器编号 | 容器体积/L | 温度/K | CO物质的量/mol | H2物质的量/mol | CH3OH物质的量/mol | 平衡时CO浓度/mol•L-1 | 平衡常数K |
| 1 | 1.0 | 500 | 0.2 | 0.2 | 0 | 0.12 | K1 |
| 2 | 1.0 | 800 | 0.1 | 0 | 0.1 | 0.16 | K2 |
| 3 | 2.0 | 800 | 0.2 | 0.2 | 0 | X | K3 |
分析 (1)CO燃烧热△H3=c kJ/mol,故燃烧热化学方程式为CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H3=c kJ/mol
①CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H1=a kJ•mol-1
②H2(g)+CO2(g)?H2O(l)+CO(g)△H2=b kJ•mol-1
③CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H3=c kJ/mol,②×2-①+③×2得,CO(g)+2H2(g)?CH3OH(g)△H=(2b-a+2c)KJ/mol,据此进行分析;
(2)①据v=$\frac{△c}{△t}$进行计算;K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$进行计算;
②A.CO(g)+2H2(g)?CH3OH(g)
开始(c) 0.2 0.2 0
变化 0.2-X 0.4-2X 0.2-X
平衡 X 2X-0.2 0.2-X,容器2与容器3温度相同,故平衡常数相同即K3=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{0.2-X}{X×(2X-0.2)^{2}}$=17.36,据此进行分析;
B.v(CO)正与v(H2)逆.都表示正反应速率,不能说明到达平衡;
C.CO(g)+2H2(g)?CH3OH(g)
开始(c) 0.2 0.2 0
变化 0.08 0.16 0.08
平衡 0.12 0.04 0.08,故平衡常数K1=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{0.08}{0.12×0.0{4}^{2}}$=416.7,此时CO转化率=$\frac{0.08}{0.2}×100%$=40%,
设CO变化了xmol
CO(g)+2H2(g)?CH3OH(g)
开始(c) 0.32 0.24 0.08
变化 x 2x x
平衡 0.32-x 0.24-2x 0.08+x,因为可逆反应不可能完全转化,故0.24-2x>0,即x<0.12,故CO转化率<$\frac{0.12}{0.32}×100%$=37.5%,故再次达到平衡时CO转化率减小;
D.由以上数据得K1>K2=K3;
(3)①甲醇燃料电池,电解质为酸,燃料为负极,故甲醇为负极,失去电子发生氧化反应,据此书写电极反应方程式;
②正极发生的电极反应为O2+4e-+2CO2=2CO32-,据此进行计算;根据n(NaOH)与n(CO2)比例关系判断反应产物,进而计算溶液中电解质物质的量,结合盐类水解与电离等判断.
解答 解:(1)CO燃烧热△H3=c kJ/mol,故燃烧热化学方程式为CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H3=c kJ/mol
①CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H1=a kJ•mol-1
②H2(g)+CO2(g)?H2O(l)+CO(g)△H2=b kJ•mol-1
③CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H3=c kJ/mol,②×2-①+③×2得,CO(g)+2H2(g)?CH3OH(g)△H=(2b-a+2c)KJ/mol,
故答案为:(2b-a+2c)KJ/mol;
(2)①CO(g)+2H2(g)?CH3OH(g)
开始(c) 0.1 0 0.1
变化 0.06 0.12 0.06
平衡 0.16 0.12 0.04
v(H2)=$\frac{△c}{△t}$=$\frac{0.12mol/L}{2min}$=0.06mol/(L•min);K2=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{0.04}{0.16×0.1{2}^{2}}$=17.36,
故答案为:0.06mol/(L•min);17.36;
②A.CO(g)+2H2(g)?CH3OH(g)
开始(c) 0.2 0.2 0
变化 0.2-X 0.4-2X 0.2-X
平衡 X 2X-0.2 0.2-X,容器2与容器3温度相同,故平衡常数相同即K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{0.2-X}{X×(2X-0.2)^{2}}$=17.36,解得X=0.16,故A错误;
B.v(CO)正与v(H2)逆.都表示正反应速率,不能说明到达平衡,故B错误;
C.CO(g)+2H2(g)?CH3OH(g)
开始(c) 0.2 0.2 0
变化 0.08 0.16 0.08
平衡 0.12 0.04 0.08,故平衡常数K1=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{0.08}{0.12×0.0{4}^{2}}$=416.7,此时CO转化率=$\frac{0.08}{0.2}×100%$=40%,
设CO变化了xmol
CO(g)+2H2(g)?CH3OH(g)
开始(c) 0.32 0.24 0.08
变化 x 2x x
平衡 0.32-x 0.24-2x 0.08+x,因为可逆反应不可能完全转化,故0.24-2x>0,即x<0.12,故CO转化率<$\frac{0.12}{0.32}×100%$=37.5%,故再次达到平衡时CO转化率减小,故C错误;
D.由以上数据得K1>K2=K3,故D正确,
故答案为:D;
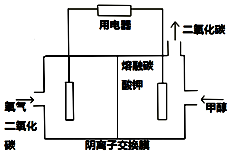
(2)①根据图知,甲醇为负极,失去电子发生氧化反应,负极反应式为CH3OH-6e-+3CO32-=4CO2↑+2H2O,
故答案为:CH3OH-6e-+3CO32-=4CO2↑+2H2O;
②正极发生的电极反应为O2 +4e-+2CO2=2CO32-
22.4 4
3.36 0.6,则V(O2)=3.36L;参与反应的氧气在标准状况下体积为3.36L,物质的量为 $\frac{3.36L}{22.4L/mol}$=0.15mol,2CH3OH+3O2=2CO2↑+4H2O,由方程式得0.15mol氧气参与反应生成二氧化碳的物质的量为0.1mol,n(NaOH)=2L×0.3mol•L-1=0.6mol,n(NaOH):n(CO2)=0.6mol:0.1mol=6:1,实质上发生反应CO2+2NaOH=Na2CO3+H2O,溶液中碳酸根水解,溶液呈碱性,故c(OH-)>c(H+),碳酸根的水解生成碳酸氢根,故c(CO32-)>c(HCO3-)钠离子浓度最大,并且溶液中还有剩余的NaOH,故c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)>c(H+),
故答案为:3.36L; c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)>c(H+).
点评 本题考查反应热,反应速率,平衡常数的计算,电极方程式的书写,及离子浓度大小的比较等知识,综合性很强,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 10ml质量分数为98%的H2SO4,用10ml水稀释后,H2SO4的质量分数大于49% | |
| B. | 配制0.1mol/L的Na2CO3溶液480mL,需用500mL容量瓶 | |
| C. | 制备Fe(OH)3胶体时,将饱和FeCl3溶液滴入沸水中,边加热边搅拌,直到得到红褐色溶液 | |
| D. | 向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2、和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SiO2、P2O5均为酸性氧化物 | |
| B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | |
| C. | 酒精、冰醋酸、草酸钾均为电解质 | |
| D. | NH4SCN、SiO2、NH3•H2O均为共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是非金属氧化物 | |
| B. | 都是酸性氧化物,都能与强碱溶液反应 | |
| C. | 都能溶于水且与水反应生成相应的酸 | |
| D. | SiO2可用于制光导纤维,干冰可用于人工降雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
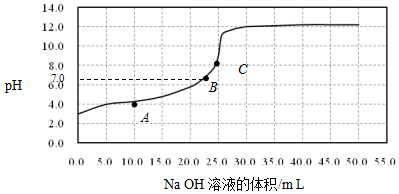
| A. | 在A点:c(HX)>c(Na+)>c(X-) | |
| B. | 在B点,溶液中c(H+)=c(OH-) | |
| C. | C点溶液中存在的主要平衡是X-+H2O?HX+OH- | |
| D. | 0.05mol/L NaX溶液的pH≈9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
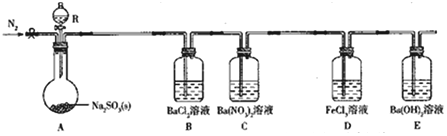
| 实验步骤 | 实验现象及结论 |
| 取少量C中反应后溶液于试管中,加入铜粉(或BaCl2溶液) | 若铜粉溶解,溶液变蓝色(或无沉淀),则猜想2正确;若铜粉不溶解(或产生白色沉淀),则猜想1正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
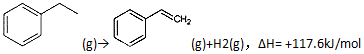
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Zn | ZnO | ZnS | CuS | BaSO4 | H2S | |
| 熔点/℃ | 419.5 | 1975(同时分解) | - | - | - | - |
| 沸点/℃ | 907 | - | - | - | - | - |
| Ksp(常温) | - | - | 2.5×10-21 | 6.4×10-35 | 1.1×10-10 | K1=1.1×10-7 K2=1.3×10-13 |
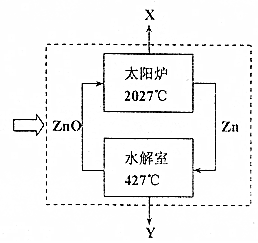
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 温度 | 0 | 10 | 20 | 40 | 50 | |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com