
【题目】C、N、O、Na、Mg、Al、S、Cl是常见的八种元素,根据元素及其化合物性质,回答下列问题:
(1)S在周期表中的位置为______;CO2的电子式是_______。
(2)比较O、Na元素常见离子的半径大小(用化学式表示,下同)____>____;__________比较S、Cl元素的最高价氧化物对应水化物的酸性强弱:____>____ 。_______________
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___________;制铝时,电解Al2O3而不电解AlCl3的原因是___________ 。
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的结构简式为______;Q的化学式为_______ 。
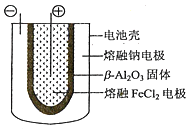
(5)熔融状态下,钠和FeCl2能组成可充电电池(装置示意图如下),反应原理为:2Na+FeCl2![]() Fe+2NaCl.放电时,电池的正极反应式为___________;充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为_______。
Fe+2NaCl.放电时,电池的正极反应式为___________;充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为_______。
【答案】 )第三周期第VIA族 ![]() r(O2-)>r(Na+) HClO4>H2SO4 MgO的熔点高,熔融时耗费更多能源,增加生产成本 AlCl3是共价化合物,熔融态难导电 CH≡CCH3 Mg2C3 Fe2++2e-=Fe 钠 β-Al2O3固体
r(O2-)>r(Na+) HClO4>H2SO4 MgO的熔点高,熔融时耗费更多能源,增加生产成本 AlCl3是共价化合物,熔融态难导电 CH≡CCH3 Mg2C3 Fe2++2e-=Fe 钠 β-Al2O3固体
【解析】分析:本题考查元素周期表和元素周期律、离子化合物和共价化合物、烃结构简式的确定、可充电电池的工作原理。
(1)根据S的原子结构示意图确定S在周期表中的位置,CO2中只含共价键。
(2)根据“层多径大,序大径小”判断离子半径大小。根据元素的非金属性强弱判断最高价氧化物对应水化物酸性强弱。
(3)根据表中信息判断,MgO的熔点高,熔融时消耗更多能源。AlCl3属于共价化合物,熔融态难导电。
(4)根据碳氢质量比计算碳氢原子个数比,根据反应的物质的量和原子守恒确定Q的化学式和烃的结构简式。
(5)可充电电池放电时为原电池工作原理,充电时为电解池工作原理。放电时的负极充电时为阴极,放电时的正极充电时为阳极。
详解:(1)S的原子结构示意图为![]() ,S在周期表中位于第三周期第VIA族。CO2的电子式为
,S在周期表中位于第三周期第VIA族。CO2的电子式为![]() 。
。
(2)O2-、Na+具有Ne的电子层结构,O2-的核电荷数小于Na+,则离子半径:r(O2-)![]() r(Na+)。S、Cl都处于第三周期,同周期从左到右元素的非金属性逐渐增强,最高价氧化物对应水化物酸性逐渐增强,非金属性:S
r(Na+)。S、Cl都处于第三周期,同周期从左到右元素的非金属性逐渐增强,最高价氧化物对应水化物酸性逐渐增强,非金属性:S![]() Cl,S、Cl的最高价氧化物对应水化物的酸性:HClO4
Cl,S、Cl的最高价氧化物对应水化物的酸性:HClO4![]() H2SO4。
H2SO4。
(3)根据表中的信息,MgO和MgCl2都属于离子化合物,MgO的熔点高,MgO熔融时耗费更多能源,增加生产成本,所以工业制镁时电解MgCl2而不电解MgO。Al2O3属于离子化合物,熔融态时能导电,AlCl3属于共价化合物,熔融态难导电,工业制铝时电解Al2O3而不电解AlCl3。
(4)该烃分子中n(C):n(H)=![]() :
:![]() =3:4,碳与镁形成的1mol化合物Q与水反应生成2molMg(OH)2和1mol烃,根据原子守恒,烃的分子式为C3H4,Q的化学式为Mg2C3。烃的不饱和度为2,烃的结构简式为CH3C
=3:4,碳与镁形成的1mol化合物Q与水反应生成2molMg(OH)2和1mol烃,根据原子守恒,烃的分子式为C3H4,Q的化学式为Mg2C3。烃的不饱和度为2,烃的结构简式为CH3C![]() CH。
CH。
(5)放电时的反应为2Na+FeCl2=2NaCl+Fe,放电时正极发生得电子的还原反应,电池的正极反应式为Fe2++2e-=Fe。放电时Na为负极,熔融FeCl2电极为正极;充电时Na为阴极,阴极与外加电源的负极相连,充电时熔融钠电极接电源的负极。根据装置图,该电池的电解质为β-Al2O3固体。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段.如图是硫元素的常见化合价与部分物质类别的对应关系:
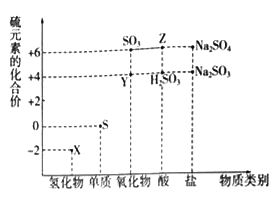
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______(填化学式).
(2)将X与Y混合,可生成淡黄色固体.该反应中氧化剂与还原剂的物质的量之比为_______.
(3)检验物质Y的方法是_______________________________.
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______.
(5)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是______(填代号).
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)已知Na2SO3能被K2Cr207氧化为Na2SO4则24mL 0.05molL﹣1的Na2SO3溶液与 20mL 0.02molL﹣1的溶液恰好反应时,Cr元素在还原产物中的化合价为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沙丁胺醇(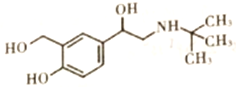 )是一种新型药物,常用于缓解哮喘等肺部疾病,其一种合成路线如下。
)是一种新型药物,常用于缓解哮喘等肺部疾病,其一种合成路线如下。
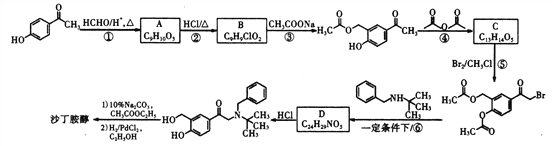
(1)沙丁胺醇的分子式为_____________,C中官能团的名称为_____________。
(2)①的反应类型为____________,⑥的反应类型为____________。
(3)B的结构简式为_____________。
(4)A在酸性条件下发生缩聚反应的化学方程式为__________________________。
(5)符合下列条件的B的同分异构体有________种(不考虑立体异构),其中任意一种的结构简式为_____________。
a.苯环上有两个取代基; b.能与NaHC03反应生成CO2。
(6)写出以苯酚、甲醛和乙酸酐(![]() )为原料制备高分子
)为原料制备高分子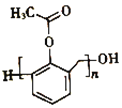 的合成路线:____________________________________________________(无机试剂任选)
的合成路线:____________________________________________________(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰(主要含有SiO2、Fe2O3、Al2O3等)是燃煤发电过程中产生的废渣。粉煤灰的综合利用具有很大的价值。
(1)煤炭在火炉中燃烧很旺时,在往炉膛内的热煤炭上喷洒少量水的瞬间,炉子内火会更旺。如果烧去同量的煤炭,喷洒过水的和没有喷洒过水的煤炭相比较,它们放出的总热量___(填“相同”或“不相同”)。这是因为:________________________。
(2)研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究。
①以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离。向分离所得的滤液中加入还原剂使Fe3+转化为Fe2+,结合下表分析其原因:___________________
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
沉淀区间(pH) | 7.06~895 | 1.94~3.20 | 3.69~4.8 |
②使用碱性较弱的氨水为pH调节剂,进行分离实验。反应终点的pH对铝和铁分离效果的影响如图1。根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是____________。
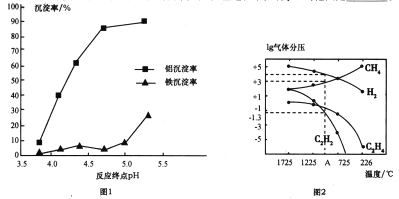
(3)工业上可利用煤的气化产物(水煤气)合成甲烷研究得出,甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图2所示。
①T℃时,向1L恒容密闭容器中充入0.3molCH4只发生反应2CH4(g)![]() C2H4(g)+2H2(g)。达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H___(填“>”或“<”)0,CH4的平衡转化率为________。
C2H4(g)+2H2(g)。达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H___(填“>”或“<”)0,CH4的平衡转化率为________。
②列式计算反应2CH4(g)![]() C2H2(g)+3H2(g)在图中A点温度时的平衡常数Kp=________(用平衡分压代替平衡浓度列式计算,不要求写单位,lg0.05=-1.3)。
C2H2(g)+3H2(g)在图中A点温度时的平衡常数Kp=________(用平衡分压代替平衡浓度列式计算,不要求写单位,lg0.05=-1.3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是

A. x=2.24 B. 铝的物质的量为0.2 mol
C. 反应时,Na、Mg、Al均过量 D. 曲线C为Al与盐酸反应的图像
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 、
、![]()
I.冠心平F是降血脂、降胆固醇的药物,它的一条合成路线如下:
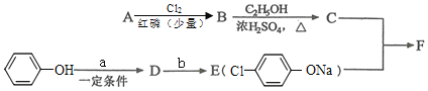
(1)A为一元羧酸,8.8gA与足量NaHCO3溶液反应生成2.24LCO2(标准状况),A的分子式为____________。
(2)写出符合A分子式的所有甲酸酯的结构简式:________________。
(3)B是氯代羧酸,其核磁共振氢谱有两个峰,写出B→C的反应方程式:____________。
(4)C+E→F的反应类型为____________。
(5)写出A和F的结构简式:____________。
(6)D的苯环上有两种氢,它所含官能团的名称为_____________;写出b所代表的试剂为____________。
II.有机物H的分子式为C2H2O3,可发生银镜反应,且具有酸性。
(7)H有多种合成方法,在方框中写出由乙酸合成H的路线流程图(其他原料任选)。合成路线流程图示例如下:![]() ________________________________________________。
________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢材在社会发展中应用广泛。为研究某种碳索钢(含少量碳和硫)的成分,科研小组进行了如下探究活动。
称取碳素钢(已除表面氧化物)24.0g放入耐高温反应管中与O2反应,除去未反应的O2,收集到干燥混合气体X 1.12L(已折算成标准状况下的体积)。
(1)科研小组用下图所示实验装置检验混合气体X的组成。

①装置B中的试剂是___________,装置C的作用是_________。
②若观察到________(填实验现象),证明X中含有CO。
(2)反应后,耐高温反应管内固体中除含有Fe3+之外,还可能含有Fe2+。要确定其中的Fe2+,可选用_______(填序号)。
a.KSCN溶液和氯水 b.KSCN溶液和铁粉
c.稀盐酸和K3[Fe(CN)6]溶液 d.稀H2SO4和KMnO4溶液
(3)科研小组用下图所示装置(部分)测定SO2的体积分数,并计算碳素钢的含碳量。将气体X缓慢通过实验装置,当观察到_____(填实验现象)时,停止通气,此时气体流量仪显示的流量为112mL(已换算成标准状况)。则气体X中SO2的体积分数为_____,碳素钢中碳元素的质量分数为_________(保留1位小数)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为金属单质,它们之间能发生如下反应(部分产物未标出)
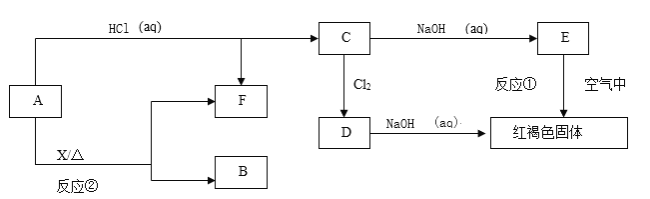
请根据以上信息回答下列问题:
(1)写出物质B、D的化学式:__________________、__________________ 。
(2)写出下列反应的化学方程式:
反应①____________________________________________________________ 。
反应②______________________________________________________________________。
(3)将B溶于盐酸完全反应,试写出反应的离子方程式:___________________________,为证明反应后溶液中浓度较低的金属离子的存在,操作为____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了证明二氧化硫和氯气的漂白性,设计了如下图所示的实验装置:
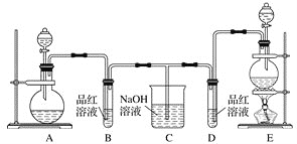
他们制备二氧化硫和氯气所依据的原理分别是:
Na2SO3+H2SO4===Na2SO4+H2O+SO2↑
MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)用来制取氯气的装置是________(填字母),反应中浓盐酸所表现出的化学性质是________________和________________。
(2)反应开始一段时间后,B、D试管中的品红溶液均褪色。停止通气后,再给B、D两个试管分别加热,__________(填“B”或“D”)试管中无明显现象。
(3)装置C的作用是____________________。
(4)若装置D中的品红溶液换成紫色的石蕊溶液,则出现的现象是__________________。
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1∶1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com