
分析 (1)(2)(3)(4)在水溶液里或熔融状态下能导电的化合物是电解质,包括:酸、碱、盐、金属氧化物;
电解质的强弱是根据电离程度划分的,在水溶液里或熔融状态下完全电离是电解质是强电解质,部分电离是电解质是弱电解质;
在水溶液里和熔融状态下都不导电的化合物是非电解质,包括:大多是有机物、非金属氧化物、氨气;
物质导电的条件为含有自由电子或者自由移动的离子;
(5)依据pH=-lg[H+]、[H+][OH-]=Kw,结合溶液稀释规律解答.
解答 解:①铁片是单质,既不是电解质也不是非电解质;含有自由电子,能导电;
②?NaNO3晶体是化合物,在水溶液里或熔融状态下能完全电离产生自由移动的离子而能导电,是强电解质,NaNO3晶体不含自由移动的电子,也不含自由移动的离子,不导电;
③?NH3•H2O 是化合物,在水溶液里部分电离产生自由移动的离子而导电,属于弱电解质;本身不含自由移动的电子,也不含自由移动的离子,不导电;
④Ba(OH)2溶液是混合物,既不是电解质也不是非电解质;含有自由移动的离子,能够导电;
⑤酒精在水溶液里和熔融状态下都不导电的化合物是非电解质;本身不含自由移动的电子,也不含自由移动的离子,不导电;
⑥SO2是化合物,但是本身不能电离产生自由移动的离子,不导电,属于非电解质;本身不含自由移动的电子,也不含自由移动的离子,不导电;
所以(1)属于强电解质的是②,
(2)属于弱电解质的是③?,
(3)属于非电解质的是⑤⑥,
(4)能导电的是?①④.
故答案为:(1)②;(2)③?;(3)⑤⑥;(4)①④;
(5)a.pH=12的Ba(OH)2溶液,氢离子浓度为1×10-12mol/L,氢氧根离子浓度为$\frac{10{\;}^{-14}}{1×10{\;}^{-12}}$=10-2mol/L,依据Ba(OH)2~2OH-,可知Ba(OH)2的物质的量浓度为$\frac{1}{2}$×10-2mol/L=5×10-3 mol/L
故答案为:5×10-3;
b.pH=12的Ba(OH)2溶液,氢离子浓度为1×10-12mol/L,则取此溶液10mL,稀释到1L,依据稀释过程中溶质的物质的量不变得稀释后氢离子物质的量浓度为:$\frac{1×10{\;}^{-12}mol/L×10mL}{1000mL}$=10-10mol/L;pH=-lg10-10=10;
故答案为:10;
c.依据H++OH-=H2O,要使溶液呈中性,则氢离子物质的量等于氢氧根离子的物质的量,设需要酸的体积为VmL,则10mL×10-2mol/L=VmL×10-3mol/L,解得V=100mL;
故答案为:100;
d.把此溶液加热至95度,氢离子物质的量浓度=$\frac{Kw}{[OH{\;}^{-}]}$=$\frac{1×10{\;}^{-12}}{10{\;}^{-2}}$=10-10mol/L,pH=-lg10-10=10,
故答案为:10.
点评 本题考查了电解质、非电解质、强电解质、弱电解质的判断,pH值的有关计算,明确相关概念及水的离子积常数、pH值计算公式是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 除(3)外 | B. | 除(4)外 | C. | 除(2)外 | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 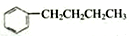 的与H2加成之后的产物中,其一氯代物有7种 的与H2加成之后的产物中,其一氯代物有7种 | |
| B. | CH3CH=CHCH3分子中的四个碳原子在同一直线上 | |
| C. | 按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 | |
| D. |  的一溴代物和 的一溴代物和  的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图①可用于实验室制备少量Cl2或NH3 | |
| B. | 可用从a处加水的方法检验装置②的气密性 | |
| C. | 实验室也可以用装置③收集HCl气体 | |
| D. | 装置④可用于苯萃取碘水中碘的实验,并把碘的苯溶液从漏斗上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{18}$O | |
| B. | 氧原子的结构示意图: | |
| C. | CaCl2的电子式: | |
| D. | 明矾的化学式:KAl(SO4)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{6}^{12}$C和${\;}_{6}^{13}$C | B. | 红磷和白磷 | ||
| C. | 丁烷和异丁烷 | D. | ${\;}_{19}^{40}$K和${\;}_{20}^{40}$Ca |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温时,某溶液的 pH小于7,则该溶质一定是酸或强酸弱碱盐 | |
| B. | 室温时,0.1mol•L-1 一元酸 HA的电离平衡常数为1×10-7,则该酸电离度约为0.1% | |
| C. | 浓度均为 0.01mol•L-1 的 CH3COOH 溶液和 CH3COONa 溶液等体积混合,混合溶液中:(CH3COO- )+c(CH3COOH)=0.02 mol?L-1 | |
| D. | 在温度不变的情况下,向MgCO3饱和溶液中加入Na2CO3溶液,MgCO3 将会析出,但Ksp不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| B. | 常温下向水中加入稀氨水,水的电离平衡逆向移动,c(OH-)降低 | |
| C. | 常温下向水中加入少量固体CH3COONa,水的电离平衡逆向移动,c(H+)降低 | |
| D. | 常温下将水加热,Kw不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com