硫、磷影响钢铁的性能.现用如下方法测定钢铁中硫的含量:先准备一只吸收瓶,瓶中盛有50.0mL0.40%的酸性淀粉溶液(内含0.0075g KI),再往其中滴入1滴标准碘酸钾(KIO3)溶液,注意此时溶液的颜色.把试样放在O2中充分燃烧,生成的气体通入上述吸收瓶,同时用装有标准碘酸钾溶液的滴定管不断进行滴定,以溶液恢复到起始时的颜色为终点.
标准碘酸钾溶液的配制方法如下:称取0.321g基准KIO3溶于适量水中,移到1L容量瓶中,加入1.0mL10%
KOH溶液,稀释到刻度,摇匀.移取100.0mL此溶液至另一只1L容量瓶中,加入1.0gKI,溶解后,加水稀释到刻度,摇匀,以此溶液为滴定液.
(1)计算滴定液中碘酸钾的物质的量浓度.
(2)写出滴定过程中发生反应的离子方程式.
(3)若钢样为0.500g,消耗碘酸钾标准溶液的体积为10.0mL,计算钢样中硫的质量分数.
解:(1)c(KIO
3)=
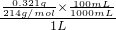
=1.5×10
-4mol?L
-1,
答:滴定液中碘酸钾的物质的量浓度为1.5×10
-4mol?L
-1.
(2)标准液中含有KIO
3和KI,碱性条件下不会反应生KI
2,加入标准液加入吸收液时,介质由碱性变为酸性,IO
3-氧化I
-为I
2,碘氧化二氧化硫为硫酸,滴定过程反应离子方程式为:IO
3-+5I
-+6H
+=3I
2+3H
2O、I
2+SO
2+2H
2O=2I
-+SO
42-+4H
+,
答:滴定过程反应离子方程式为:IO
3-+5I
-+6H
+=3I
2+3H
2O、I
2+SO
2+2H
2O=2I
-+SO
42-+4H
+.
(3)3S~3SO
2~3I
2~IO
3- 3 1
4.5×10
-6 mol 1.5×10
-4mol?L
-1×10×10
-3L
故S%=
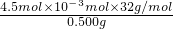
×100%=0.0288%
答:钢样中硫的质量分数为0.0288%.
分析:(1)根据n=

计算0.321g基准KIO
3的物质的量,进而计算100mL溶液中含有的KIO
3的物质的量,再根据c=

计算;
(2)标准液中含有KIO
3和KI,碱性条件下不会反应生KI
2,加入标准液加入吸收液时,介质由碱性变为酸性,IO
3-氧化I
-为I
2,碘氧化二氧化硫为硫酸,据此书写;
(3)根据关系式3S~3SO
2~3I
2~IO
3-计算S的物质的量,根据m=nM计算硫元素质量,再利用质量分数定义计算.
点评:本题考查氧化还原反应滴定、碘元素化合物性质、化学计算等,难度较大,清楚发生的反应是解题的关键,注意利用关系式进行计算.

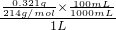 =1.5×10-4mol?L-1,
=1.5×10-4mol?L-1,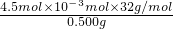 ×100%=0.0288%
×100%=0.0288%  计算0.321g基准KIO3的物质的量,进而计算100mL溶液中含有的KIO3的物质的量,再根据c=
计算0.321g基准KIO3的物质的量,进而计算100mL溶液中含有的KIO3的物质的量,再根据c= 计算;
计算;
