
 (1)甲醇是一种优质燃料,可制作燃料电池.
(1)甲醇是一种优质燃料,可制作燃料电池.| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ?mol-1 | 348 | 413 | 436 | 358 | 750 | 463 |
| 3 |
| 2 |
| ||
| ||
| 890.3 |
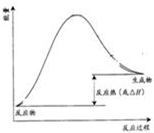 ,故答案为:
,故答案为: .
.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
| A、v(A)=0.5mol/(L?s) |
| B、v(B)=0.3 mol/(L?s) |
| C、v(C)=0.8 mol/(L?s) |
| D、v(D)=1 mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1CH3COOH溶液加水稀释,溶液中所有离子浓度均减小 |
| B、常温下,在由水电离出的c(OH-)=1×10-12mol?L-1的溶液中,Al3+可能大量存在 |
| C、常温下,向AgCl悬浊液中加入少量NaCl固体后振荡,Ksp(AgCl)增大 |
| D、常温下,相同浓度的CH3COONa溶液与Na2CO3溶液相比,Na2CO3溶液的pH小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| W | X | Y | Z | |
| 结构 或 性质 |
最高价氧化物是温室气 体,其原子的最外层电子 数是次外层电子数的2 倍 |
最高价氧化物对 应的水化物与其 气态氢化物反应 得到离子化合物 |
氧化物是常见的两性化合物 | 最高正价与最 低负价之和为 零 |
查看答案和解析>>
科目:高中化学 来源: 题型:
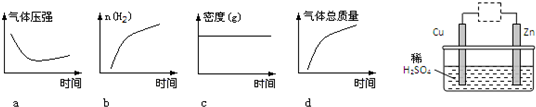
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| 1 |
| 2 |
| ||
| 1 |
| 2 |
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com