
【题目】Mg-AgCl电池是一种以海水为电解质溶液的水激活电池,下列叙述错误的是
A.负极反应式为Mg-2e-=Mg2+
B.正极反应式为Ag++e-=Ag
C.电池放电时Cl-由正极向负极迁移
D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不满足下图所示转化关系的是( )

甲 | 乙 | 丙 | 戊 | |
A | NH3 | Cl2 | N2 | H2 |
B | C | SiO2 | CO | CuO |
C | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | CO2 |
D | 乙醇乙酯 | NaOH溶液 | 乙醇 | 乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是( )

A.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B.比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
C.M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D.在M–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W~H 有如下的转化关系。已知W、B为芳香族化合物,X为卤素原子,W、A、B均能与NaHCO3溶液反应,A分子中有2个甲基,H分子中含有醛基且苯环上的取代基处于对位。
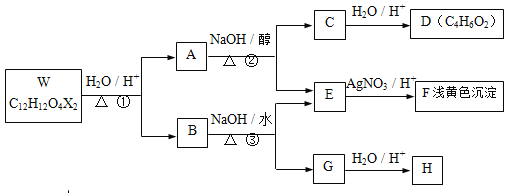
已知:
请回答下列有关问题:
(1)反应①、②分别属于 反应、 反应(填有机反应类型),A、B中均含有的含氧官能团的名称是 。
(2)F的化学式 ,B的结构简式 。
(3)反应②的化学方程式是 。
(4)若![]()
则反应④的化学方程式是 。
(5)H有多种同分异构体,且满足下列3个条件
(i) 遇FeCl3显紫色 (ii)苯环上一取代物有两种 (ⅲ)除苯环外无其它环状结构
试写出三种符合条件的同分异构体的结构简式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:

(1)③⑤⑥⑦中原子半径最大的是 (用元素符号表示,下同),②③④⑤的简单离子中半径最小的是 。
(2)③⑤中元素的金属性强弱顺序为 ,⑥⑦元素的非金属性强弱顺序为 。
(3)①、②两种元素按原子个数比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 。
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。

①写出D溶液与G反应的化学方程式 。
②写出电解A溶液的化学方程式: 。
③若上图中E、F按等物质的量进行反应,则混合物X中含有的物质有 (水忽略) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
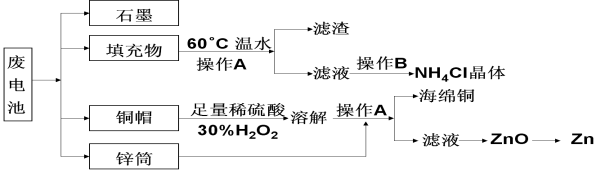
(1)填充物用60℃温水溶解,目的是_____________________。
(2)操作A的名称为______________。
(3)铜帽溶解时加入H2O2的目的是(用化学方程式表示)。铜帽溶解完全后,可采用___________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为_______________________。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为 __________________________________。
①当1 mol MnO2参加反应时,共有_____________mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该应的化学方程式:_____________。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:

根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率_____________________。
②在强酸性环境下Hg的吸收率高的原因可能是_______________KMnO4在酸性条件下强。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)pH值相同的HCl(aq)、H2SO4(aq)、CH3COOH(aq)各100 mL
①三种溶液中物质的量浓度最大的是 。
②分别用0.1 mol/LNaOH(aq)中和,消耗NaOH(aq)最多的是 。
③反应开始时,反应速率 。
A、HCl最快 B、H2SO4最快 C、CH3COOH最快 D、一样快
(2)某温度下,纯水中的c(H+)= 2.0×10-7 mol/L,则此时c(OH -)= mol/L。
(3)室温时,将pH=12的Ba(OH)2溶液和pH=9的KOH溶液按1∶1的体积比混合,则混合后溶液中的c(H+)≈ mol/L(计算结果用a×10n的形式表示,a为小于10的正整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家冶炼出纯度高达99.9999%的铁。你估计它不会具有的性质是
A. 硬度比生铁低 B. 与4mol/L的HCl反应时速率比生铁快
C. 在冷的浓硫酸中可钝化 D. 在潮湿的空气中不易生锈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在特制漏斗中将铝热剂混合均匀后,引发铝热反应的操作是:____________。
(2)硅与铝同周期.地壳里硅铝的含量硅____________铝(填>,<或=)。工业上制备金属铝的化学方程式是: ____________,工业上制备硅的化学方程式有:
a.SiO2+2C![]() Si(粗)+2CO
Si(粗)+2CO
b.SiO2+3C![]() SiC +2CO(副反应),
SiC +2CO(副反应),
c.Si(粗)+ 2C12![]() SiCl4
SiCl4
d.SiC14 + 2H2![]() Si+4HC1,
Si+4HC1,
某同学将氧化还原反应、非氧化还原反应及四大基本反应绘制成上图,其中属于上图“2"区域的反应是____________ (填序号)。

(3)SiO2是硅酸盐玻璃(Na2CaSi6O14)主要成分,Na2CaSi6O14也可写成Na2OCaO6SiO2,钠长石(NaAlSi3O8)的氧化物形式____________,长石是铝硅酸盐,不同类长石其氧原子的物质的量分数相同.由此可推知钙长石的化学式为____________。
(4)某铝合金由Al、Si、Cu、Mg组成。①称取100g该铝合金样品,分成等质量的A、B两份。向A 份加入足量NaOH溶液,B份加入足量的稀盐酸。②待两份反应物都充分反应之后,称得滤渣质量相差1.60g,收集得到的两份气体的体积相差2240mL(标准状况下)。则样品中Si和Mg的物质的量分别是n(Si)____________和n(Mg)____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com